Izadi Jakintza»Izadi jakintza
Entzimak

LABURPENA: entzimak proteinak dira, izaki bizietan gertatzen diren erreakzioak
katalizatzen espezializatuak; horrek esan nahi du erreakzio horiek lasterrago edo organismoentzako
baldintza egokiagoetan gertatzen direla, baina entzimak berak eraldatzen
ez direla. Oso eraginkorrak izaten dira katalizatzen duten molekularen gainean;
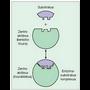
substratu deritzaio molekula horri. Zentro aktibo bat dute, erreakzioa gertatzen dena,
eta zentroak berak ere finkapen zentro bat du, hari lotzen baitzaio substratua, eta katalisi
zentro bat, erreakzioa gertatzen dena.
Erreakzioa gertatzean, entzima substratuari lotzen zaio, eta konplexu aktibo bat sortzen
da gero, berehala hausten dena, gaia eta entzima jatorrizko egoeran askatuz.
Entzimek, inhibitzaile deritzaten gaiak direla medio, eraginkortasuna gal dezakete,
inhibitzaileek entzimak aldatzen baitituzte, betiko (inhibizio itzulezina) edo aldi
baterako (inhibizio itzulgarria).
Erreakzioak katean gertatzen dira normalean, entzima alosteriko izeneko entzima
bereziek kontrolatzen dituztela.Erreakzio kimiko asko gertatzen da izaki
bizien zelulen barnean, eta erreakzio
horiek osatzen dute metabolismoa. Kasurik
gehienetan ordea erreakzio hauek ez dira
berez gertatzen, aldiz, halako energia kopuru
bat behar dute hasteko. Bi eratako erreakzio
kimikoak bereizten dira:
- Erreakzio exorgoniko edo berezkoak.
Gaiak berak gai erreakzio-eragileak (erreaktiboak)
baino energia gutxiago duten erreakzioak
dira. Sobrako energia bero forman
galtzen da, beroa askatzen baita erreakzioa
gertatzean (1. irudia). - Erreakzio endorgonikoak. Gaiak erreaktiboek
baino energia handiagoa duten erreakzioak
dira; hau da, beste era batera esanda,
kanpoko energia behar dute gertatzeko (2.. rudia).
- Erreakzio endorgonikoak. Gaiak erreaktiboek
baino energia handiagoa duten erreakzioak
dira; hau da, beste era batera esanda,
kanpoko energia behar dute gertatzeko (2.. rudia).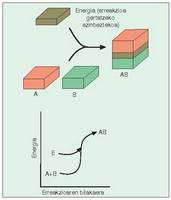 Azken erreakzio mota horrekin loturik,
katalizatzaileak aurkitu ziren. Gai horiek
berezitasun bat dute: erreakzioan parte
hartu gabe, nabarmen lasterragotuz eragiten
dute; horien eragina ?aktibazio energia? gutxitzean
datzala erabaki da, eta hori beharrezko
da erreakzioan parte hartzen duten
gaiak elkarri eragin, eta espero den gaia sor
dezaten (3. irudia).
Azken erreakzio mota horrekin loturik,
katalizatzaileak aurkitu ziren. Gai horiek
berezitasun bat dute: erreakzioan parte
hartu gabe, nabarmen lasterragotuz eragiten
dute; horien eragina ?aktibazio energia? gutxitzean
datzala erabaki da, eta hori beharrezko
da erreakzioan parte hartzen duten
gaiak elkarri eragin, eta espero den gaia sor
dezaten (3. irudia).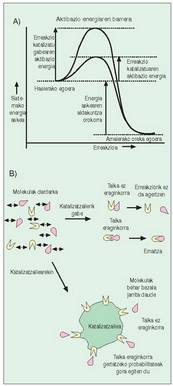
Entzima erreakzioa
Esan den bezala, metabolismoan parte hartzen duten katalizatzaileak dira entzimak.
Alabaina, erreakzio kimiko arruntetan parte hartzen duten katalizatzaileek ez bezala, bi ezaugarri berezi dituzte: - Bereziak dira substratuaren arabera, hau da, entzima bakoitzak gai jakin baten gainean bakarrik eragiten du, edo elkarren artean oso erlazio estua duten gaien gainean.
- Bereziak dira erreakzioaren arabera.
Hots, gai batek bi erreakzio desberdin izan baditzake, entzima bereziek katalizatuko dituzte erreakzio horiek.
Nola agertu berezitasun horiek? Entzima guztiak proteinak direnez gero (aipaturiko RNAk salbu), zergatia ez datza beren konposizioan, eta, hortaz, jardun motan behar du egon, hau da, erreakzioan.
Badakigu entzima substratuari lotzen zaiola konplexu aktibatu edo konplexu entzima-substratu bat osatuz, eta aktibazio energia deritzan energia hornidura behar duela horretarako (beroa normalean); konplexuaren bizitza oso laburra da, ezen oso laster zatitzen baita, gaia eta entzima eraldatu gabea emateko.Entzima + Substratua  Konplexu aktibatua
Konplexu aktibatua  Entzima + Gaia.
Entzima + Gaia.
Entzimak substratuetan egiten duen hautaketaren zergatia bi molekulen arteko lotura puntuan datza; zentro aktibo esaten zaio entzimaren puntu horri. Hiru aminoazido mota ditu (4. irudia): - Finkapen aminoazidoak: substratuarekin loturak osatzen dituzte, oso indartsuak izaten ez direnak, erreakzioa gertatzean entzima aska dadin. Finkapen zentro deitu zaion zentro aktiboaren parte bat osatzen dute.
- Finkapen aminoazidoak: substratuarekin loturak osatzen dituzte, oso indartsuak izaten ez direnak, erreakzioa gertatzean entzima aska dadin. Finkapen zentro deitu zaion zentro aktiboaren parte bat osatzen dute.
- Aminoazido katalizatzaileak: lotura kobalente bidez lotzen zaizkio susbstratuari; lotura horiek aurrekoak baino gogorragoak dira, eta substratuaren loturak ahultzeko eginkizuna dute, eta haien haustea erraztu. Aminoazidohauek zentro katalitiko deritzan zentro aktiboaren beste parte bat osatzen dute.
Entzimaren bi zentroak elkarren ondoan egoten dira normalean.
Entzima jakin batek bere substratua ?ezagutu? dezan, bi baldintza bete behar dira: egiturazko ezaugarriren bat, finkapen zentroarekiko lotura bidera dadin, eta lotura kimiko bat, zentro katalizatzailearen jardunaz hautsi behar dena (5. irudia). Nolakoak diren bata eta bestea, hala eragingo dio entzimak substratu jakin bati ala ez dio eragingo.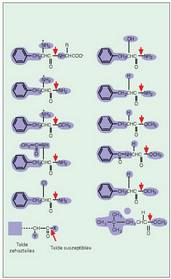 Erreakzioak katalizatzerakoan, ez dute lastertasun berberez jokatzen entzima guztiek eta, horren ondorioz, badirudi faktorebatzuek zerikusia dutela entzima jakin batek erreakzio bat katalizatzean duen eraginkortasunean.
Erreakzioak katalizatzerakoan, ez dute lastertasun berberez jokatzen entzima guztiek eta, horren ondorioz, badirudi faktorebatzuek zerikusia dutela entzima jakin batek erreakzio bat katalizatzean duen eraginkortasunean.
Faktore horien artean hauek aipa daitezke:- Substratuaren hurbiltasuna eta orientazioa.
Hau da, katalisi zentroak, erreakzio zentroak eta jardun behar den substratuaren parteak oso-osorik lerrokaturik behar dute egon (6. irudia).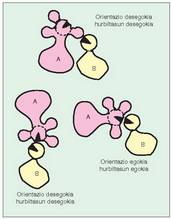 Baldintza horiek ez badira betetzen, nola kataliza dezake entzimak erreakzioa? Gerta daiteke, besterik gabe, entzimak substratu kopuru handiak "itsastea" bere gainean.
Baldintza horiek ez badira betetzen, nola kataliza dezake entzimak erreakzioa? Gerta daiteke, besterik gabe, entzimak substratu kopuru handiak "itsastea" bere gainean.
Erreakzio kimikoen lastertasuna gai erreaktiboen kontzentrazioarekin lotua dagoenez gero, lastertasuna gehitu egiten da, nahiz eta ez den gehitzen "entzima on" baten kasuan bezala, alegia, aurreko baldintzak betetzen diren entzimaren kasuan bezala.- Katalisi kobalentea. Entzima batzuek lotura kobalentez aktibaturiko konplexu bat eratzeko duten ahalmenarekin du honek zerikusia; molekula oso erreaktiboa bihurtzen da, substratua entzimarekin lotu aurretik izango litzatekeena baino askoz ere erreaktiboago.
Alegia, substratuaren egitura aldatu egiten da lotura kobalente berriak sortzean lotura guztiak aldatzen direlako, eta horrek askoz erreaktiboagoa bihurtzen du (7. irudia).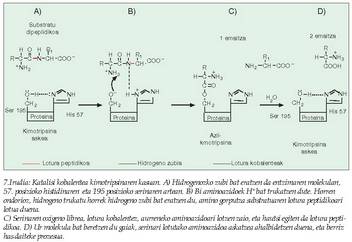 - Azido-base katalisia. Entzimaren aminoazido batzuk gauza dira protoiak (H + ) emateko edo beretzeko, eta era horretan substratutik hurbilen dagoen pH-a erregulatzen dute, eta erreakzioa errazten. Adibide batez argi daiteke hau: lotura peptidikoen haustura oso maila apalean gertatzen da.
- Azido-base katalisia. Entzimaren aminoazido batzuk gauza dira protoiak (H + ) emateko edo beretzeko, eta era horretan substratutik hurbilen dagoen pH-a erregulatzen dute, eta erreakzioa errazten. Adibide batez argi daiteke hau: lotura peptidikoen haustura oso maila apalean gertatzen da.
(Zineman, azidoz beteriko bainuontzi batean sartuz desagertarazten dituzte hiltzaileek beren biktimen gorpuak). Entzima batzuk ordea, kimotripsina adibidez, pH neutroko lotura horiek hausteko gai dira, hautsibeharreko loturaren gertueneko ingurua oso azidoa bihur dezaketelako. Hipotesi horren lagungarri, esan behar da badela aminoazido mota jakin bat askoz eragin handiagoa izan dezakeena azido-base jokoan, eta aminoazido hori askoz ere sarriagoa izaten da entzimetan beste proteina motetan baino (8. irudia).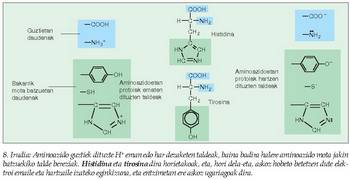 - Tentsio faktorea. Entzima eta substratua, lotu ondoren, elkarri "egokitzen" zaizkio, eta, era horretan, askoz ere erreaktibogoak bihurtzen dira bi molekulak (9.. rudia).
- Tentsio faktorea. Entzima eta substratua, lotu ondoren, elkarri "egokitzen" zaizkio, eta, era horretan, askoz ere erreaktibogoak bihurtzen dira bi molekulak (9.. rudia).
Entzima zinetika
Erreakzioen lastertasunen azterketaz arduratzen den kimikaren adarra da zinetika; hortaz, entzimek parte hartzen duten erreakzioen lastertasuna aztertzen du entzima zinetikak.Substratuaren kontzentrazioaren araberakoa
da entzima erreakzioaren lastertasuna,
alegia, substratu erabilgarria duen neurrianhazten da, harik eta, konplexu aktibo moduan, entzima osoa substratuaren molekulekin konbinaturik dagoen unea iristen den arte. Une horretan lastertasuna apaltzen da, ez baita beste erreakziorik izango entzimaren molekularen bat aske geratu eta beste substratu batekin konbinatzeko gai ez den arte. Orduan entzimaren kontzentrazio jakin baterako lastertasun maximoa lortu dela esaten da (10. irudia); erreakzio lastertasunaren kurban lastertasun iraunkor moduan ageri da, grafikoan lerro zuzen gisa adierazten dena.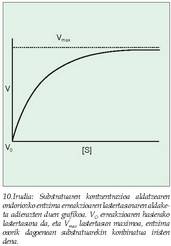 L Michaelisek eta M. Mentenek, arazoari irtenbidea emateko, entzima erreakzioa orekazkoa zela proposatu zuten (11. irudia).
L Michaelisek eta M. Mentenek, arazoari irtenbidea emateko, entzima erreakzioa orekazkoa zela proposatu zuten (11. irudia).
Lehen unean (Vo), entzima baino askoz ere substratu gehiago dago, eta, hori dela-eta, konplexu aktiboaren hausturarena bera izango da erreakzioaren lastertasuna. Ekuazio hori guztiz baliozkoa den arren, terminoak ezin dira zuzenean kalkulatu, eta, hori dela-eta, parametroak ezagunak diren beste adierazpenen batera jo beharra dago.
Ekuazio hori guztiz baliozkoa den arren, terminoak ezin dira zuzenean kalkulatu, eta, hori dela-eta, parametroak ezagunak diren beste adierazpenen batera jo beharra dago.
Konplexu aktibatua denboran osatzea (d [ES] / dt, matematika ikurretan), entzima kontzentrazioen eta substratuaren mende dago, ekuazio honen arabera: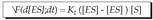 Hau da, oraindik libre dagoen entzimaren araberakoa da: entzima kontzentrazio osoa, ken konplexu aktibatua osatzen duen entzima partearen kontzentrazioa, eta substratuarena.
Hau da, oraindik libre dagoen entzimaren araberakoa da: entzima kontzentrazio osoa, ken konplexu aktibatua osatzen duen entzima partearen kontzentrazioa, eta substratuarena.
Gaia eta entzima elkartuta ere osa zitekeen konplexu aktiboa, baina, erreakzioa beti gaiaren eraketa aldera gertatzen denez,  dela suposatzen da. Alegia, erreakzio hori ez dela gertatzen.
dela suposatzen da. Alegia, erreakzio hori ez dela gertatzen.
Alabaina, alderantzizko erreakzioa ere posible da; hau da, konplexu aktiboa desagertu egiten da pixkana (-d [ES] / dt), eta berriz ere entzima eta substratua ematen ditu. Hau da prozesu horren ekuazioa: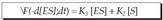 Hau da, entzima-substratu konplexuaren
suntsitzea gai bihurtzen den lastertasunaren,
eta berriz entzima eta substratua ematen
dituen lastertasunaren araberakoa da.
Hau da, entzima-substratu konplexuaren
suntsitzea gai bihurtzen den lastertasunaren,
eta berriz entzima eta substratua ematen
dituen lastertasunaren araberakoa da.
Oreka egoeran, suntsitzen den neurrian
adina ekoizten da konplexu aktibatua, eta,
hori dela-eta, bi ekuazioak berdin daitezke: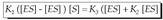 Aurreko ekuazioa berrantolatuz,
Aurreko ekuazioa berrantolatuz,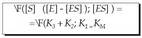 KM Michaelis-Menten konstantea deritzana izanik, edo entzima erreakzioen orekaren konstantea. Ekuazio honetan badira jada kontzentrazioak, esperimentuz neur daitezkeenak.
KM Michaelis-Menten konstantea deritzana izanik, edo entzima erreakzioen orekaren konstantea. Ekuazio honetan badira jada kontzentrazioak, esperimentuz neur daitezkeenak.
Konstantearen ekuazioan, konplexu aktiboaren kontzentrazio balioa bakan daiteke,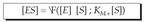 eta, ondoren, hasierako lastertasuna jakin nahi
genuen ekuazioan, balio hori ordezkatu:
eta, ondoren, hasierako lastertasuna jakin nahi
genuen ekuazioan, balio hori ordezkatu: Substratuaren kontzentrazioa oso handia
denean, ia entzima osoa egoten da subtratuarekin
konbinaturik, eta erreakzioaren lastertasuna
konstante bihurtuko da. Alegia,
lastertasun maximoa iritsiko da, soil-soilik
entzimaren kontzentrazioaren mendekoa
izango dena (entzima gehiago eransten bada
bakarrik gehituko da). Ondorengo matematika
adierazpenean ageri da hori:
Substratuaren kontzentrazioa oso handia
denean, ia entzima osoa egoten da subtratuarekin
konbinaturik, eta erreakzioaren lastertasuna
konstante bihurtuko da. Alegia,
lastertasun maximoa iritsiko da, soil-soilik
entzimaren kontzentrazioaren mendekoa
izango dena (entzima gehiago eransten bada
bakarrik gehituko da). Ondorengo matematika
adierazpenean ageri da hori: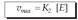 Hasierako lastertasunaren ekuazioan
Hasierako lastertasunaren ekuazioan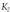 [E] -ren balioa ordezkatuz, adierazpen hau lortuko dugu:
[E] -ren balioa ordezkatuz, adierazpen hau lortuko dugu: Entzima erreakzio baten Michaelis-Menten
ekuazioa esaten zaio azken adierazpen
horri.
Entzima erreakzio baten Michaelis-Menten
ekuazioa esaten zaio azken adierazpen
horri.
Erreakzio horretatik garrantzi handiko
ondorio bat ateratzen da, hasierako lastertasun
maximoaren erdia den kasu berezian
aplikatuz: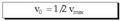 Termino bakoitzaren ordez aurreko ekuazioetan
zuen balioa ipiniz,
Termino bakoitzaren ordez aurreko ekuazioetan
zuen balioa ipiniz, 
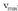 -ez zatituz, hau lortzen da:
-ez zatituz, hau lortzen da: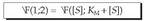 Eta, berrantolatuz, hau lortuko dugu:
Eta, berrantolatuz, hau lortuko dugu:
Entzimen egitura
Entzima guztiak proteina diren arren, bi talde handi bereizten dira: aminoazido hutsez osaturiko entzimak, holoentzimak, eta proteina ez den parteren bat dutenak.
Bigarren sail horretako entzimen proteinazko parteari apoentzima esaten zaio. Proteinazkoa ez den partean, bi gauza gerta daitezke: gai inorganikoa izatea, gai desberdinen ioi metalikoak normalean, hala zinka (Zn), magnesioa (Mg) edo potasioa (K), eta kasu horretan kofaktore esaten zaio; proteinazkoa ez den gai organikoa ere izan daiteke, eta koentzima esaten zaio orduan. Koentzima kobalentziaz lotua egon daiteke, era iraunkorrean, entzimarekin (mioglobinaren hemo parteari gertatzen zaion bezala), edo entzimari lotu dakiokesubstratuaren aldaketa gertatzen den unean. Entzimaren kasuan ez bezala, koentzima eraldatu egiten da entzima erreakzioan zehar, baina berehala osatzen da berriz ere erreakzioa bukatzean.
Koentzima arruntenak elektroi eramaileak dira; aipagarrienak hauek dira: nikotin-adenin-nukleotidoa (NAD) eta haren forma fosforilatua (NADP), flabin-mononukleotidoa (FMN) eta flabin-adenin-dinukleotidoa (FAD). A koentzima (CoA) da beste koentzima oso garrantzitsua, azilo taldeen transferentzian erabiltzen dena . Horiez gainera, aipatu beharrekoak dira adenin-trifosfato (ATP) eta adenosin-difosfato (ADP) energia eramaileak (12. irudia).
. Horiez gainera, aipatu beharrekoak dira adenin-trifosfato (ATP) eta adenosin-difosfato (ADP) energia eramaileak (12. irudia).
Entzimen nomenklatura
Gaurko nomenklatura sistema zenbakizkoa da, eta sei familiatan zatitzen ditu entzimak, katalizatzen dituzten erreakzioen arabera (I. koadroa). Familia bakoitzari zenbaki bat izendatzen zaio. Familia bakoitzaren barruan, mota desberdinak bereizten dira, atomo taldearen arabera, edo entzima jakin batek eragiten dion loturaren arabera; horietako bakoitzak erreferentzia zenbaki bat ere badu.
Familia horiek, era berean, azpimultzoetan sailka daitezke; azpimultzoei beste zenbaki batzuk ipintzen zaizkie, eta era horretan gero eta gehiago zehazten da entzimaren jardun mota (II. koadroa). Hortaz, entzima bakoitza guztiz definiturik geratzen da, lau zenbakiren bidez; zenbaki horiek Entzima Batzordeak deritzanak normalizatzen ditu.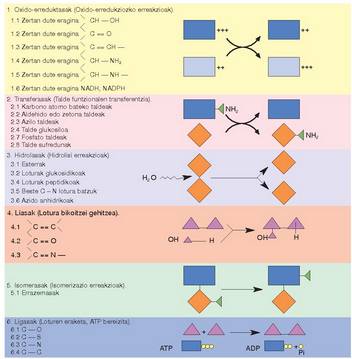
Entzima inhibizioa
Kimikari eta biokimikarien ametsa da atal honetan deskribatu dena: lastertasun harrigarriz gertatzen diren erreakzioak, nahi bezalako baldintzetan, katalizatzaileak eta entzimak erabiltzeari esker. Gordinagoa da ordea errealitatea: erreakzio guztiak ezin dira katalizatzaile edo entzima bidez lasterragotu, ezta nahi bezalako baldintzetan ere.
Horrez gainera, katalizatzaileak ?pozoitu? egin daitezke, alegia, beren gaitasuna kenduko dieten gai arrotzek eraso diezaiekete.
Antzeko gauza gertatzen da entzimen kasuan ere; eraginkortasuna gal dezakete, inhibitzaile izeneko gai sail batekin konbinatzenbadira. Normalean, formaz substratuaren antzeko samarrak diren molekulak izaten dira (finkapen zentroari lotzen zaion molekularen partean gutxienez), edo kimika nolakotasuna antzekoa dutenak (katalisi zentroari lotu ahal izateko).Inhibizioa iraunkorra ala iragankorra izan daiteke, eta, hortaz, bi mota nagusi bereizten dira:
- Inhibizio itzulgarria. Inhibitzailearen eta entzimaren arteko lotura ahula denean gertatzen da; oso erraz bana daiteke, eta entzimak berriz jarduten du banatu ondoren. Bi aldaera ditu:
+ Inhibizio lehiakorra. Inhibitzailea substratuaren oso antzekoa da, eta lehian aritzen dira biak entzimaren zentro aktiboari lotzeko (13. irudia). Inhibizio mota honen irtenbidea substratuaren kontzentrazioa gehitzea da; izan ere, kasu horretan gutxitu egiten da entzima eta inhibitzailea elkartzeko probabilitatea.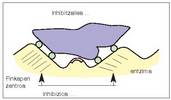 + Inhibizio ez lehiakorra. Entzimaren zentro aktiboa blokeatzen da, bai inhibitzaileak, finkapen zentroari loturik, substratua zentro katalitikoraino iristea eragozten duelako, bai inhibitzaileak gaia askatzea eragozten duelako (14. irudia).
+ Inhibizio ez lehiakorra. Entzimaren zentro aktiboa blokeatzen da, bai inhibitzaileak, finkapen zentroari loturik, substratua zentro katalitikoraino iristea eragozten duelako, bai inhibitzaileak gaia askatzea eragozten duelako (14. irudia).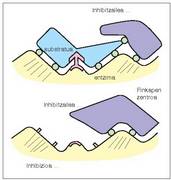 - Inhibizio itzulezina. Inhibitzailea lotura
gogorrez lotzen zaio entzimari; zentro aktiboaren
osakera aldatzen du, edo modu
iraunkorrez haren lekua hartzen. Era horretan,
betiko galtzen du entzimak erabilgarritasuna
(15. irudia).
- Inhibizio itzulezina. Inhibitzailea lotura
gogorrez lotzen zaio entzimari; zentro aktiboaren
osakera aldatzen du, edo modu
iraunkorrez haren lekua hartzen. Era horretan,
betiko galtzen du entzimak erabilgarritasuna
(15. irudia).
Entzima erreakzioen kontrola
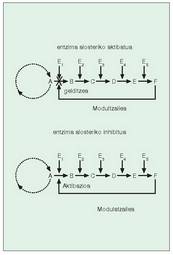
Entzima erreakzioak, erreakzio baten emaitza hurrengoaren substratu delarik, katean gertatu ohi dira. Kate hauek, jakina, ezin dute etengabe martxan egon, aldiz,bat behar dute, behar den unean ?abian jarri? eta ?gelditu? ahal izateko. Katean dauden entzima alosteriko direlakoen bidez lortzen da hori.
Azpibanako edo protomero batek baino gehiagok osatzen dute normalean entzima alosteriko bat; azpinabanako horiek zentro aktibatzaile eta zentro aktibo bana izaten dute. Zentro erregulatzaileari molekula berezi bat elkartzen zaionean, aktibatzaile edo modulatzaile deitua, bi gauza gerta daitezke (16. irudia):