Izadi Jakintza»Izadi jakintza
Bizitzaren oinarri kimikoa
Izaki biziek Lurraren azalean diren osagai kimiko egonkor gehien-gehienak erabiltzen
dituzte; baina osagai horiek proportzio desberdinetan daude Lurrean eta organismoetan.
Izaki biziek atomo mota jakin batzuk erabiltzen dituzte batez ere, bizitzaren
beharretarako hobeto egokitzen direnak, bioelementuak alegia. Organismoetan dituzten
proportzioen arabera, biolementu nagusiak, bigarren mailakoak eta oligoelementuak
bereizten dira.
Bioelementuak beren artean elkartzen dira eta era horretan biomolekulak sortzen
dituzte. Berriz ere, izaki bizien dinamikaren beharrak direla-eta, lotura kimiko jakin
batzuk besterik ezin dira gertatu, materia biziaren molekulak osatzeko.Antzina-antzinatik, materiaren nolakotasuna
ezagutzen saiatu dira zientzialariak,
materia osatzen duten oinarrizko zatikiak
bakartuz. Grekoek atomo deitu zituzten
materiaren zati txikienak, materiak bere
tasunak galtzen baititu atomoaz behetiko
osagaietan.
XX. mendea ondo sartu arte, Lurraren eta
espazioaren zokoak miatu dituzte zientzialariek,
eta atomo mota desberdinak aurkitu
dituzte, gai bakun edo elementu izendatu
direnak. Gaur egun, eskura dugu oinarrizko
gaien zerrenda bat, gai bakunen taula periodikoa
deritzana, oraingoz dakigunaren arabera,
materiaren edozein zati osatzen duten
105 atomo motak ordenaturik ageri direna.
Gai bakunak elkarren artean konbinatzen
dira, eta era horretan gai kimiko elkartuak
sortzen dituzte; horiek osatzen dituzte unibertsoan
diren gauzakiak, huts-hutsean
nahiz elkarrekin nahasturik.
Bizitzaren muinarena da antzina-antzinatik
zientzialariak kezkatu dituen beste arazo
bat. Gauza da, oharkabean ia, gai izaten
garela kasurik gehienetan ?gauzaki? biziak,
edo izaki bizietatik datozenak, eta bizigabeak
edo mineralak bereizteko. Horrek pentsarazten
digu alde guztiz funtsezkoa behar
duela izan organismoei dagokien materia
biziaren, eta materia bizigabe edo mineralaren
artean, ez baitute itxuraz erlaziorik.
Arazo hori argitzeko, izaki biziak batetik,
eta, bestetik, Lur planetaren geruzak osatzen
dituzten kimika gai bakunen analisiak egin
dira. Analisi horien emaitzen arabera, 70 gai
bakun dituzte guztira izaki biziek beren
batez besteko osakeran; hau da, gas noble
deritzaienak salbuetsita, Lurraren azalean
diren gai iraunkor gehienak.
Materia bizia osatzen duten gai bakun
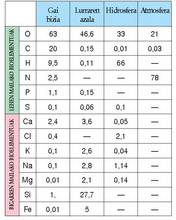
horiei bioelementu deitzen zaie.I. Taulan, izaki bizietan eta planetaren
geruzetan ugarien diren elementuen batez
besteko portzentzaiak alderatzen dira.Taula xehetasunez aztertzen bada, izaki
biziek ez dituzte erabiltzen ingurunean
eskura dituzten elementuak ingurune horretan
duten proportzio beraren arabera; aitzitik,
hautatu egiten dituzte. Hori dela-eta,
pentsatzekoa da gehiago erabiltzen dituztela
beren beharrei ondoen egokitzen zaizkien
gaiak.
II. taulan oso izaki bizi desberdinen osakera
ageri da (erreinu desberdineko izakiak
dira), eta guztiz agerikoa da osakera hori oso
71antzekoa dela kasu guztietan. Garbi ikusten
da beraz elkarrekin harremanetan daudela
izaki bizi guztiak; hau da, jatorrizko organismo
mota bakar batetik bilakaeraz garatu
direla, eta organismo horrek ordurako egina
izango zuela bizitzaren beharrei ondoen egokitzen
zaizkien atomoen hautaketa.Ez da oraindik argitu nahitaezkoak ote
diren bioelementuak ?bizitza? ezaugarria
sorrarazteko; horren erantzuna exobiologiak
(Lurretik kanpora izan daitekeen bizitza
aztertzen duen biologiaren adarrak) lehen
fruituak ematen dituenean etorriko da,
Lurraz kanpoko organismoek Lurrekoen
antzeko konposizioa duten ala ez aztertzen
duenean.
Bioelementuak
I. eta II. taulen azterketak lehen ondorio bat jartzen du agerian, alegia, elementu guztiak ez direla proportzio berean aurkitzen izaki bizietan. Hori dela-eta, hiru kategoria nagusitan sailkatu ahal izan dira: - Biolementu nagusiak edo primarioak Materia bizian gutxi gorabehera %96ko proportzioan ageri direnak dira. Kategoria horren baitan daude karbonoa (C), hidrogenoa (H), oxigenoa (O), nitrogenoa (N), fosforoa (N), eta sufrea (S).
Biolementu nagusiak izaki biziak osatzen dituzten molekulak osatuz konbinatzen dira elkarrekin; horiei biomolekula edo lehen osagai esaten zaie.
Zergatik nahiago ote dituzte izaki biziek bioelementu horiek? Bizitzaren ezaugarrietako batean aurkitu behar da erantzuna, hau da, gai horien plastikotasun izugarrian. Izaki biziek aldaera asko eta asko dituzte, ez formari dagozkionak bakarrik, baita funtzionamenduzkoak ere. Horrez gainera, metabolismoa da organismoen beste ezaugarri bat, hau da, materia bizia aldaketa prozesu etengabean egotera behartzen duten erreakzio saila.
Bestalde, ez da gauza ona biomolekulak oso egongaitzak izatea; izan ere, hala balitz, behar ez denean aldatuko lirateke, etahorrek, metabolismoaren prozesua desitxuratuz,
arazo larriak sortuko lituzke, zenbaitetan
izakia suntsitzeraino.
Hori dela-eta, beharrezkoa da aldatzeko
gaitasunaren eta iraunkortasunaren arteko
oreka ez galtzea. Eginkizun hori, oreka gordetzea
alegia, ezin hobeto betetzen dute biolementu
nagusiek, beren artean lotura kobalenteak
sortzeko gauza direnez gero (aurrerago
aztertuko da gai hau). Lotura kobalenteen
ezaugarria da, iraunkor izanik ere, ez dutela
hausteko zailtasunik, eta era horretan molekula
berriak sortzen dituzte. Bestalde, karbonoak,
oxigenoak eta nitrogenoak, elektroi bat
baino gehiago komuna izateko ahalmena dute
(lotura kobalentea, funtsean, elektroi pareak
komunak dituzten atomoak dira), eta era
horretan lotura bikoitzak eta hirukoitzak sor
daitezke, biomolekulei are ugaritasun handiagoa
eman dietenak (I. irudia).Horrez gainera, karbonoa gauza da karbonoarekin
berarekin elkartzeko, eta era
horretan biomolekulen hezurdura osatzen
duten karbonozko katea luzeak sortzen
dira, biziki tamaina luzeetaainokoak hain
zuzen. Karbonoak karbonoarekin elkartzeko
duen tasun hori dela-eta, katea linealak
sor daitezke, baina baita katea adardunak
eta ziklikoak ere; arrazoi bat
gehiago bizitzaren molekulen aldakortasunaren
alde.
Bioelementu nagusiak izadian diren arinenetakoak
dira, eta, horregatik, horiez eratzen
diren molekulak ere, neurriz handiak
izan arren, ez dira astunegiak izaten. Horrela
errazago egokitzen dira organismoak
Lurraren grabitate eremura.
- Bigarren mailako bioelementuak
Sail honetan sartzen dira organismoetan
kopuru txikietan dauden elementu desberdin
asko. Materia biziaren %3 baino gehiago
osatzen dute.Izaki bizien jardunaren alderdi desberdinetan
garrantzi erabakigarria duten arren, ez
dira gai bizi guztietan ageri, eta horren arabera
bi multzo handitan banatu dira:
+ Bigarren mailako bioelementu ezinbestekoak,
izaki bizi guztietan ageri direnak. Sail
horretakoak dira kaltzioa (Ca), sodioa (Na),
potasioa (K), magnesioa (Mg), kloroa (Cl),
burdina (Fe), silizioa (Si), kobrea (Cu),
manganesoa (Mn), boroa (B), fluorra (F) eta
iodoa (I).
Elementu horien eginkizunak zerikusi
estua du organismoen baitako erreakzio eta
funtzioekin; erreakzio eta funtzio horietako
asko xehetasun handiz aztertzen dira liburu
honetan. Hala, magnesioa klorofilaren
molekularen oinarrizko osagaia da; burdina
eta kobrea arnas pigmentuetan dira funtsezkoak,
eta elektroi garraiatzaileetan; kaltzioa
oinarri-oinarrizkoa da oskolak eta hezurrak
osatzeko; nerbio bultzada gerta dadin nahitaezkoak
dira kloroa, sodioa eta potasioa;
iodoa gizakien hazkundea erregulatzen duenhormonan parte da; azkenik, fluorra hortzen
funtsezko osagaia da, fluor faltak ahultasuna
dakar eta kariesak errazago agertzen
da fluorra eskas bada, eta, horregatik, herri
askotan edateko urari gehitzen zaio zaio.
+ Bigarren mailako bioelementu aldakorrak
ez daude izaki bizi guztietan, baina guztiz
garrantzitsuak dira ageri diren organismoen
jardunean. Horien artean aipatzekoak
dira aluminioa (Al), bromoa (Br), zinka
(Zn), titanioa (Ti), banadioa (V), molibdenoa
(Mo), eta beruna (Pb).
Adibide gisa, molibdenoa nahitaezkoa da
bakterio batzuek atmosferako nitrogenoa
finka dezaten; zinka erabakigarria da entzima
batzuek jardun dezaten, entzimen osagaiek
loturari eusten baitiote; zenbait animalia
hezurgaberen odoleko zelulek
dauzkaten pigmentuetan ageri da banadioa;
horrez gainera, landare batzuek aluminio
edo berun apur bat behar izaten dute (garoak
adibidez), garatu ahal izateko.
- Oligoelementuak
Izaki bizietan oso kopuru txikietan agertu
ohi dira (%0,1 bat baino gutxiago). Hala
ere, guztiz garrantzitsuak dira. Hauetakoa
da kobaltoa (Co), bitamina baten oinarrizko
osagaia dena (B arena).
12
Organismo jakinei begiratuz gero, sail
bateko elementu bat igaro daiteke beste
batera. Hala, izaki bizien multzoari dagokionez,
silizioa bigarren mailako biolementua
da; baina, diatomoetan (alga mota bat),
primarioa da, oskol babeslearen osagaia
baita.
Biomolekulak osatzen: loturak
Alferrik hautatuko lituzkete izaki biziek
kimika osagaiak, elementu horiek biomolekulak
sorrarazteko elkartuko ez balira; izanere, organismoen osagai funtsezkoak dira
biomolekulak. Hala ere, kimika elementuekin
gertatzen den bezala, kimika lotura guztiak
ez dira egokiak substantzia biziaren eskakizunetarako,
hau da, egonkortasun eta
malgutasun beharretarako. Horregatik, lotura
mota hauek ageri dira biomolekuletan:- Lotura kobalentea
Elektronegatibitatea duten bi atomoen
arteko lotura da; hau da, elektroi kopuru
bertsua falta zaie beren azken geruzak (maila
edo geruza desberdinetan ibiltzen baitira
elektroiak orbitan), taula periodikoan beren
lerroko bukaeran dagoen gas nobleak duen
kopuru bera izan dezan (eta horrek egonkortasuna
ematen die). Atomo horien soluzioa
elektroi pare komunak izatea da, atomo
bakoitzak elektroi bana emanez. Era horretan,
bi atomoen arteko lotura kobalenteen
kopurua elektroi pare komunen kopuruaren
berdina da (3. irudia).
Nahiko lotura gogorra da, hausteko aski
energia behar duena.- Ioi lotura
Lotura mota hau oso elektronegatibitate
desberdina duten atomoen artean sortzen
da. Beste era batera esanda, horietako bati
oso elektroi gutxi falta zaizkio azken geruzan
dagokion gas noblearen pareko izateko (eta
horregatik, elektroi gose handia du), eta besteari
berriz asko falta zaizkio egitura horretara
heltzeko (eta, horregatik, elektroiak galtzeko
eta taula periodikoko aurre-aurreko
zerrendako gas noblearen elektroi egitura
hartzeko joera du, eta horrek ere egonkortasuna
ematen du). Kasu honetan ere erraza da
soluzioa: atomo elektronegatiboenak bestearen
elektroiak beretzen ditu, era horretan
karga negatibo handiagoa hartzen duela, eta
ioi negatibo, edo anioi, bihurtzen da; emaileak
karga negatiboa galtzen du, eta ioi positibo
edo katioi bihurtzen da (4. irudia).Lotura mota hori oso gogorra da, baina ur
soluzioetan oso erraz hausten da. Urak
molekula bipolarra izateko tasuna du (hauda, ertz positibo bat du, eta beste bat negatiboa),
soluzioan; ioi bakoitza ur molekula
orientatuz inguratua geratzen da, halako
eran non ioiarekin elkartzen baita ioi horren
kontrako karga duen molekularen partea;
era horretan elkarrengandik bereiz daitezke,
eta ioi hidratutatuak sortzen dira (4. irudia).
- Lotura ahulak
Lotura mota hauek ez dira atomoen artean
sortzen, molekula desberdinen artean
baizik, eta oso erraz hausten dira. Hain
zuzen ere, ahultasun horretantxe dago izaki
bizientzat duten baliagarritasuna, lotura
horiez baliatzen baitira molekula handiak
eta zelula egiturak sortzeko; era horretan
malguak gertatzen dira, eta guztiz egokiak
molekulek izan ohi dituzten sorrera eta
suntsitze prozesu etengabeentzat.
Lotura ahuletan, lau mota nagusi bereizten
dira:
+ Hidrogeno zubiak. Hidrogeno atomoak
beste atomo mota oso elektronegatibo batzuekin
(nitrogeno eta oxigenoarekin, adibidez)
lotura kobalentez elkartuta daudenean gertatzen
dira. Hori dela-eta, elektronegatiboenak
areago erakartzen du elektroi pare komuna,
eta, hala, hidrogenoa haietatik urruti eta karga
birtual positiboarekin geratzen da (ez du elektroirik
galtzen, eta, hortaz, ez da ioi izatera
heltzen). Bestalde, badira oso atomo elektronegatiboak
karbonoarekin kobalentziaz
lotuak (biomolekuletan, oxigenoa batez ere),
eta, arrazoi beragatik, indartsuago erakartzen
dituzte elektroiak, eta karga birtual negatiboarekin
geratzen dira (5. A irudia).
Hidrogenozko zubia sortzen da, toles efektu
batez, karga desberdina duten molekula
beraren bi segmentu elkarren aurrez aurre jartzen
direnean, edota bi molekula desberdinetan
dauden kontrako karga duten bi zona
elkarren aurrez aurre jartzen direnean (5 B
irudia).
+ Van der Waalseen indarrak. Molekula
baten nukleoek beste baten nukleoak erakartzen dituztenean sortzen dira, edo, toles
batean, molekularen beraren beste segmentu
bat erakartzen dutenean.
Atomoen nukleoek positiboki kargaturiko
protoiak dauzkate beren baitan, atomoaren
beraren elektroiak erakartzen eta nukleoaren
inguruan orbitan edukitzen
dituztenak. Alabaina, eta ahulagoa bada ere,
erakarpen horrek badu eraginik inguruko
molekuletan dauden atomoen elektroietan
ere. Eta jakina, bada halaber bi molekulen
atomoen elektroiek eragindako efektua ere,
eta, karga bera izanik, elkarrengandik aldaratzeko
joera dute (6 A irudia). Nolanahi
ere, nukleoak direla-eta, aldaratze indarra ez
da erakarmena adinakoa, eta era horretan
molekulak lotuak gertatzen dira.
Era honetako sistema batean, zenbat eta
gehiago izan eragindako molekulak dituzten
atomoak, hainbat eta handiagoa izaten da
erakarpena, eta horregatik, loturaren indarra
areagotu egiten da molekula pisuarekin
batera. Horrez gainera, zenbat eta hurbilagoegon eragindako gaiak, handiagoa izango da
erakarpena (6 B irudia).
+ Lotura hidrofobikoak urarekin afinitaterik
ez duten atomoen artean sortzen diren
indarrak dira. Hori ulertzeko nahikoa da
uretan nahastezina den gai bat gogoratzea,
olioa adibidez. Ontzi batean uretan olio
pixka bat botatzen denean, olioaren molekulek
elkarturik egoteko joera dute. Ontziari
eragiten bazaio, olio tanta txikiak geratuko
dira uretan suspentsioan (hau da,
molekula multzo handiak, bakarturik geratzera
jotzen dutenak), eta oso bizkor lotzen
dira berriro elkarrekin berriz ere hasierako
egoerara itzultzeko.
+ Ioi lotura ahulak sortzen dira ur soluzioan
atomo sailak positiboki edo negatiboki
kargatuak geratzen direnean.
Molekula organiko jakin batzuk ur soluzioan
jartzean, atomo sail batzuek ioitze
prozesu bat jasaten dute, eta ioi hidratatuak
sorrarazten dituzte; era horretan, karga elektriko desberdineko atomo sailak sortzen
dira, eta horiek, aurrez aurre geratzean,
molekula baten edo molekula desberdinen
segmentuak lotzeko balio dute (7. irudia).
Elkarri eragiten dioten atomo sailen arteko
distantziak eragotzi egiten du zeinu desberdineko
kargen arteko erakarpena ioi
lotura benetakoaren kasuan bezain indartsua
izatea, lotura horretan molekula bakarraren
atomoek parte hartzen baitute.







