Fisika-Kimika»Fisika - Kimika
Disoluzioak
Isurkariak edo likidoak
Isurkariak edo likidoak gasen eta gotorren arteko egoeran daude eta horrexegatik dira zailagoak behar bezala aztertzeko eta ulertzeko. Isurkariko molekulak sobera trinkotuak aurkitzen dira eta molekulen arteko indarrak ez dira nolanahikoak. Isurkarien tasunak, gasenak ez bezala, asko aldatzen dira molekulen izaeraren arabera (tamaina, forma, elkar ekintzak). Bestalde, isurkari baten molekulak ez daude arau ordenatuak errespetatuz antolatuta. Horregatik, isurkari baten egitura deskribatzea gas batena edo gotor batena deskribatzea baino zailagoa da.
Isurkariak oso garrantzitsuak dira izadian: ez dago uraren garrantzia begiratu besterik. Ura izadiko elementurik ugariena da (lur azaleko %72 osatzen du) eta lurrin, gotor eta isurkari moduan egon badaiteke ere, gehiena isurkari moduan aurkitzen da. Isurkariak aipatzerakoan ura izango da nagusia. Gainera erreakzio kimiko asko eta asko uretan gertatzen dira, hots, disoluziotan. Ura da disolbatzailerik arruntena eta merkeena.
Lur azaleko uraren %97 ozeanoetan aurkitzen da, gainontzekoa da ur geza. Honetatik %2,1 glaziarretan eta izotz geruzetan dago. Beraz, eskuratzeko moduan, ibaietako, aintziretako eta lurpeko ura baizik ez dugu. Ura etengabe itxuraz aldatzen ari da, ziklo bat osatuz. Aintzira eta ibaietan dagoena lurrindu eta eguratsera pasatzen da eta euria edo elurra egiten duenean lur azalera itzultzen da berriz. Azkenik, ibaietatik edo lurrazpiko bideetatik itsaso eta ozeanoetara iristen da. Itsasoko urak sodio kloruro (gatz) gehiegi dauka guretzat erabilgarria izateko (edateko edo beste erabilpen baterako). Zenbait herrialdetan itsasoko ura destilatuz ur geza edangarria lortzen da (ad. Israel edo Kuwaiten) baina prozedura oso garestia da. Itsasoko ura beste substantzia askoren biltegi ere bada, aipagarriak dira horien artean, sodio katioia(*), magnesio katioia, kaltzio katioia, potasio katioia, kloruroa, sulfatoa, hidrogeno karbonatoa,bromuroa, …e.a. Munduan kontsumitzen den sodio kloruro gehiena itsasoko uretik lortzen da.

Itsaso eta ozeanoetan aurkitzen da lur azaleko uraren %97a.
Giro beroko lurralde askotan itsasoko ura lurrintzen uzten da gatza hauspeatu arte. Magnesioa, adibidez, urari karea gehituz lortzen da:
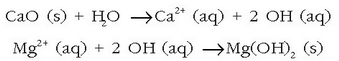
eta magnesio hidroxidoa hauspeatzen da. Hidroxido hau iragazi eta magnesio kloruro bihurtuko da azido klorhidrikoarekin erreakzionatutakoan:
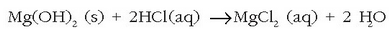
Magnesio klorurozko disoluzioa lurrindu egiten da magnesio kloruro gotorra lortzeko. Azkenik, funditu eta elektrolisiaz magnesioa eta kloroa lortzen dira.
Uraren araztea
Etxeetan, industrian edo nekazaritza munduan erabiltzen den ura ibaietatik, aintziretatik eta lurrazpiko uretatik lortzen da. Ur hori erabili ahal izateko, behar bezala tratatu beharra dago, bakterioak eta bestelako ezpurutasun arriskutsuak desagertarazteko. Hurrengo irudian ura arazteko egitura klasikoa agertzen da.
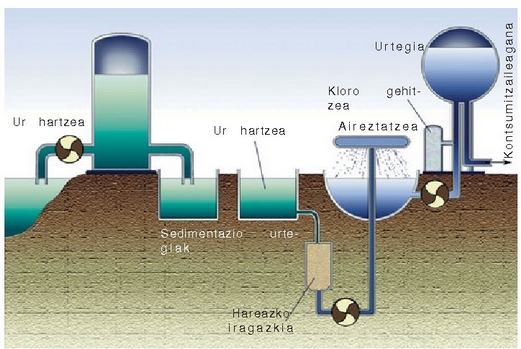
Ura bildu eta egiten zaion lehenengo gauza iragaztea da eta ondoren urtegi handietan gordetzen da piskanaka-piskanaka hareak eta bestelako partikula txikiak hondora joateko. Hauspeaketa horri laguntzeko urari karea gehitzen zaio, ura alkalinatzeko:
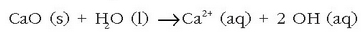
eta ondoren aluminio sulfatoa gehitzen zaio, gel itxurako aluminio hidroxidozko hauspeakina lortzeko:
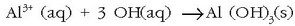
Hauspeakin hau piskanaka-piskanaka ontziaren hondora doa, eta bidean dauden hainbat partikula
(bakterioak gehienak) berarekin daramatza. Ondoren ura berriz iragazi eta karbono aktiboan
zehar pasarazten da, oraindik uretan gelditzen diren ezpuru gehienak kentzeko.
Jarraian ura airean lainoztatzen da disolbaturik aurkitzen diren gai organikoen
oxidazioa bizkortzeko. Azkenik, urari gai oxidatzaileak botatzen zaizkio bakterio guztiak suntsitzeko.
Oxidatzaile ezagunenak ozonoa 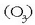 eta kloroa
eta kloroa 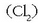 dira.
Lehenengoak duen arazoa da hantxe bertan prestatu behar dela da, hots, ezin da garraiatu bere tasunak galdu gabe.
Kloroa berriz, leku batetik bestera eraman daiteke bere propietateak galdu gabe. Kloroak uretan disolbaturik dagoenean azido
hipoklorosoa ematen du eta hauxe da ahalmen desinfektatzailea duena:
dira.
Lehenengoak duen arazoa da hantxe bertan prestatu behar dela da, hots, ezin da garraiatu bere tasunak galdu gabe.
Kloroa berriz, leku batetik bestera eraman daiteke bere propietateak galdu gabe. Kloroak uretan disolbaturik dagoenean azido
hipoklorosoa ematen du eta hauxe da ahalmen desinfektatzailea duena:
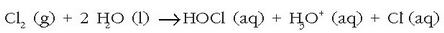
Bakterio guztiak desagertarazteko oso kloro gutxi behar da (1 ppm, gutxi gora behera) eta kantitate horretan ez da arriskutsua gizakiontzat.
Tratamendu osoa egin ondoren ez dugu ur aratza izango, uretan katioiak eta anioiak egongo dira baina dauden kantitateetan ez dira arriskutsuak guretzat eta gainera gorputzak behar dituen mineralak emango dizkigute. Uretan zenbait gas egongo da disolbaturik, hala nola, oxigenoa, nitrogenoa edo anhidrido karbonikoa.
Disoluzioak
Azukre koskor bat uretara botatakoan azukrea nola desagertzen den ikusten da, hau da, disolbatu egiten da. Zer gertatu zaio azukr eari? Isurkari bihurtu al da? Azukre gehiago botaz gero, kantitate batetik aurrera ez da desagertuko eta ontziaren beheko aldean geldituko da. Zergatik ez da nahi adina azukre disolbatzen?
Disoluzioa esaten denean, molekula mailan sakabanatutako gaien nahaste homogeneoa esan nahi da. Beraz, disoluzioa fase bakarrez osaturik egongo da. Disoluzioan parte hartzen duten osagaien arabera disoluzio bitarrak, hirutarrak …e.a. izango ditugu. Proportzio handienean aurkitzen den osagaiari disolbatzailea esaten zaio eta besteei solutu. Egoera fisikoaren arabera, disoluzio mota desberdinak daude:

Gas guztiak elkarrekin nahaskorrak dira, hots, denek ematen dituzte disoluzioak. Disoluzio gotorrak ezagunak baldin badira ere, ezagunenak edo arruntenak disoluzio isurkariak dira, eta hauen artean, gotor edo solido bat isurkari batean disolbaturik dagoen kasua.
Disoluzioa gertatuko den ala ez, bi faktorek mugatuko dute: askatu edo zurgatutako beroak eta sisteman irabazi edo galdutako ordenak. Edozein prozesutan, beroa askatzeak eta sistemaren desordena handitzeak prozesua gertatzearen alde egingo dute. Disoluziobat osatzerakoan gehienetan sistemaren desordena handiagotuko denez, prozesua mugatuko duena askatu edo zurgatutako beroa izango da. Bero honi disoluzio-beroa esaten zaio eta elkar ekintzek eta disolbatzaile eta solutu kantitateek mugatuko dute. Disoluzio bat gertatzeko hasierako osagaietan zeuden elkar ekintzak apurtu eta elkar ekintza berriak osatu beharko dira. Disoluzio prozesua errazago gertatuko da, lehenengoak txikiak izanik, elkar ekintza berriak sendoak direnean.
Esplika al daiteke disoluzioaren gertakaria teoria zinetikoaren bitartez? Azukre zati bat uretara botatzen dugunean, uraren molekulek azukrearen gainazaleko molekulak erakarri eta, behar izanez gero, beste azukre molekuletatik banan ditzakete. Disoluzioa gainazalean gertatzen den prozesua denez, irabiatuz gero, azkarrago disolbatuko da azukrea uretan (ez da gehiago disolbatuko, azkarrago baizik). Disoluzio prozesuarekin batera, uretan disolbaturik aurkitzen diren azukre molekulak elkarri lotu eta berkristaliza daitezke. (Gogoan izan ontzi itxi batean gertatzen zirela lurrintzea eta isurkaritzea). Azukre kantitatea handia baldin bada, azukrearen berkristalizatzea disolbaturik aurkitzen den azukre kontzentrazioaren araberakoa denez, une batean bi lastertasunak berdindu eta sistema orekara helduko da (oreka dinamikoa). Disoluzioak ez du solutu gehiago onartzen, hots, ase dela esango dugu.
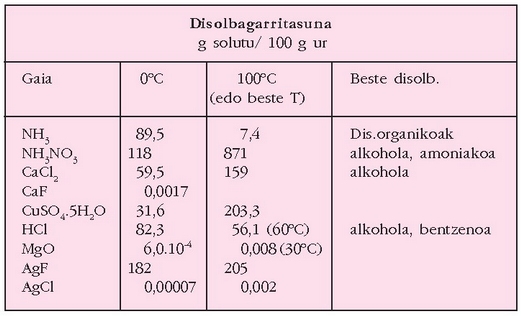
Solutu batek disolbatzaile batean duen disolbagarritasuna zera izango da: tenperatura jakin horretan disoluzio aseak izango duen kontzentrazioa, ad. 20 ºC-tan, azukreak uretan duen disolbagarritasuna 1,311 g/l-koa da. Oro har, disolbagarritasuna tenperaturarekin handitu egiten da.

Ondorengo taulan, zenbait gaik, uretan, beste disolbatzaile batzuetan, eta tenperatura desberdinetan duten disolbagarritasuna agertzen da.
Koloideak
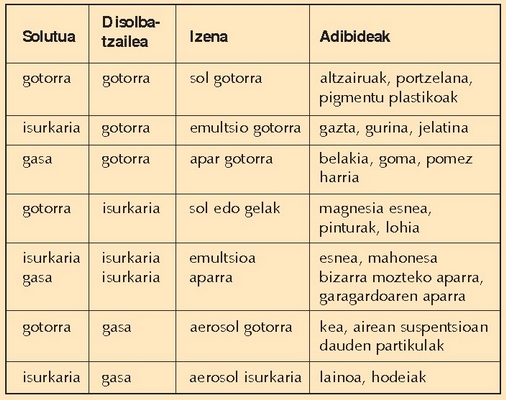
Disoluzio bat nahaste homogeneo bat dela esaten da. Nolanahi ere, bi osagai, edozein, elkarrekin nahastean, gerta daiteke nahaste homogeneo bat eratzea, edo ez eratzea. Suspentsioen kasuan, berriz, nahastea ez da homogeneoa, eta irabiatu ondoren bi faseak elkarrekin nahasten badira ere, osagaietako bat nola jalkitzen den ikus daiteke. Ura eta harea nahastean, adibidez, argi ikusten da hori. Bada ordea bi kasu horien tarteko beste bat: koloideena, hain zuzen ere. Suspentsioa, koloidea eta disoluzioa nahasteko partikulen tamainaren arabera bereizten dira.
Nahaste batean barreiaturiko partikulen tamaina

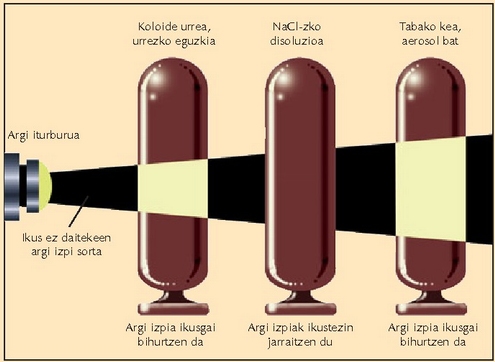
Koloideak, suspentsio koloidalak edo barreiadura koloidalak, beste bien arteko nahaste mota bat dira. Halakoetan, solutuaren partikulak disolbatzailearen fasean barreiaturik daude, baina hain txikiak dira partikulak, ezen jalkitzerik ere ez baita gertatzen. Hala eta guztiz ere, ez dute benetako disoluzio baten itxurarik, uherrak izaten baitira, eta opakoak ere bai askotan. Disoluzio koloidal batean zehar igaroarazitako argi izpia barreiatua izaten da; fenomeno optiko horrek erabilera asko ditu.
Koloide motak eta adibideak:
Behe lainoko egun batean autoen argiek argia barreiatzen duten bezala barreiatzen du,
gela ilun batean, airean dagoen hautsak argi izpi bat. Argi barreiatze hori oso arrunta
da koloideetan, eta Tyndall efektu esaten zaio. Argi ikuskorra barreiatu ahal izateko partikulak
 izan behar ditu,
gutxi gorabehera. Disoluzioek ez dutenez barreiatzen, partikulak
izan behar ditu,
gutxi gorabehera. Disoluzioek ez dutenez barreiatzen, partikulak
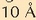 baino txikiagoak izango dira.
baino txikiagoak izango dira.
Koloideen artean hidrofilikoak eta hidrofobikoak bereiz daitezke. Lehenengoen artean proteinak (hemoglobina, adibidez) daude. Izaki bizidunetan dauden ur disoluzioetan proteinek sola eratzen dute (hemoglobina odol plasman, adibidez). Proteinak makromolekulak dira eta uretan tolesten eta biribilkatzen dira; proteinaren kanpoaldean talde polarrak gelditzen dira, eta apolarrak, berriz, barnean. Beste koloide hidrofilikoak protoplasmak edo gizakiaren zelulak izan daitezke. Azken bi horiek gelak dira, partikula gotorrak (proteinak eta karbohidratoak batez ere) ingurune gotor samar batean.
Koloide hidrofobikoak bitxiagoak dira; gisa honetako koloide bat izateko emultsionatzaile bat behar izaten da nahitaez. Emultsionatzaileak partikula barreiatuak inguratu eta egonkortu egiten ditu, jalkitzerik gerta ez dadin. Esnearen eta mahonesaren kasua da: lehenengoan koipea uretan mantentzen da barreiaturik, jalki gabe, eta bigarrenean, olioa ozpinetan. Olioa eta ozpina irabiatuz gero, fase bat bestean barreiatzen da, baina denbora batez bakarrik; gero, bi faseak bereizi egingo dira. Nolanahi ere, sistema horri emultsionatzaile bat gehituz gero (arrautzaren gorringoa, adibidez, kasu honetan) emultsio egonkorra lortuko da.
Xaboiak eta bestelako garbikariak emultsionatzaileak dira; ura eta olioa duen nahaste batera gehituz gero, eta ongi nahastuz gero, benetako emultsio bat nola sortzen den ikus daiteke.
Izadian koloide asko dago, baina batzuetan beharrezkoa izaten da koloidea deuseztea eta partikula koloidalak ingurunetik bereiztea gatzatuz edo flokulazioz. Gatzatzea modu askotara egin daiteke. Errazena beharbada, koloidea berotzea da. Beste batzuetan koloide hidrofobiko bati elektrolitoak gehitzen zaizkio. Ibai bateko uretako lokatza edo lohia koloide hidrofobiko bat da adibidez; buztinezko partikulak barreiaturik daude, eta partikula horien gainaldean hidroxido ioiak daude. Ibaiko ura ozeanora iristen denean itsasoko uraren katioiek (sodioa eta magnesioa) koloide horiek neutralizatuko dituzte. Partikula koloidal neutro horiek elkarrekin talka egitean, beren tamaina handitu egingo da, eta jalki egingo dira azkenean. Keak aerosol gotorrak dira eta beren partikula gotorrek (ikatza edo kedarrak) gainaldea kargatuta izaten dute. Industria bateko ketik partikula koloidalak kentzeko Cottrell hauspeatzailetik igaroarazten da kea. Karga elektrikoa duen xafla batetik igaroarazten da kea, partikulak kargagabe gelditzen dira, eta ke hauts gisa hauspeatzen dira.
Solutuaren eragina disolbagarritasunean
Gai batzuk uretan disolbagarriak diren bezala, beste batzuk oso gutxi disolbatzen dira eta beste batzuk batere ez. Disolbagarritasun desberdin horri esker errazago ulertzen dira izadian gertatzen diren gertaera asko. Adibidez, nitrato gehienak oso ongi disolbatzen dira uretan, horregatik da zaila nitrato biltegiak izadianaurkitzea. Honen salbuespena Txileko nitrato biltegi naturala da, hau da, Txileko itsasertzean (lehorrean) aurkitzen diren sodio nitratozko biltegi handiak, ingurune horretan ez dagoelako ia lurrazpiko urik. Biltegi natural hau ongarriak eta leherkariak prestatzeko nitrato iturri naturala izan da urteetan, harik eta amoniakoaren Haber prozesua mende honen hasieran garatu zen arte.
Bestalde, fosfato gehienek disolbagarritasun baxua dute uretan eta hau mesedegarria da gure hezurdurarentzat (nagusiki kaltzio fosfatozkoa baita). Disolbagarritasun baxu hori, ordea, eragozpen nabaria da nekazaritza munduan, fosforoaren zirkulazioa ekosisteman zehar oso mantsoa baita eta behar-beharrezkoa da zelula biologikoetan. Kimikarien ikerkuntzan puntu nagusi bat fosfatoen lastertasuna edo abiadura bizkortzea izan da ongarri gisa lanean ari direnean. Ongarrietan erabilitako fosfato eta hidrogeno fosfatoak fosfatozko harrietatik (apatitak, hidroxiapatita eta fluoroapatita) ateratzen dira azido sulfurikoarekin erreakzionaraziz:
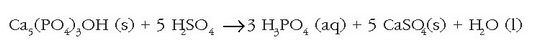
Kaltzio hidrogeno fosfatoa 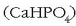 kaltzio fosfatoa
kaltzio fosfatoa 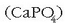 baino errazago
disolbatzen denez, ongarrietan agertzen da.
baino errazago
disolbatzen denez, ongarrietan agertzen da.
Fosfatoekin gertatzen denaren antzera, hidrogeno karbonatoek (bikarbonatoak,
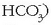 ere disolbagarritasun
handiagoa dute karbonatoek baino. Desberdintasun honen ondorioz ur gogorrek portaera bitxia dute.
Ur gogorrak esaten denean kaltzio eta magnesiozko gatzak kantitate handi samarretan disolbaturik
dituzten urak adierazi nahi dira. Katioi horiekin batera beste zenbait anioi dituzte:
kloruroa,
ere disolbagarritasun
handiagoa dute karbonatoek baino. Desberdintasun honen ondorioz ur gogorrek portaera bitxia dute.
Ur gogorrak esaten denean kaltzio eta magnesiozko gatzak kantitate handi samarretan disolbaturik
dituzten urak adierazi nahi dira. Katioi horiekin batera beste zenbait anioi dituzte:
kloruroa, 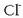 , sulfatoa,
, sulfatoa,
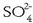 , eta bikarbonatoa,
, eta bikarbonatoa,
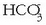 nagusiki.
nagusiki.
Izadiko ur gehienak, eta nagusiki kararrizko inguruneetan, gogorrak dira. Zer arazo dakartzate
ur gogor hauek egunoroko bizitzan? Adibidez, xaboiak (sodio estearatoa,
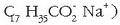 ur gogorretan gatz
berezi bat ematen du, xaboiaren anioiak (ad. estearatoak) uretako kaltzio katioiarekin
kaltzio gatz disolbaezinak ematen baititu (kaltzio estearatoa). Gainera hodi beroetan
(ur beroa pasatzen delako) hauspeakina agertzen da
ur gogorretan gatz
berezi bat ematen du, xaboiaren anioiak (ad. estearatoak) uretako kaltzio katioiarekin
kaltzio gatz disolbaezinak ematen baititu (kaltzio estearatoa). Gainera hodi beroetan
(ur beroa pasatzen delako) hauspeakina agertzen da
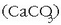 ondorengo erreakzioaren ondorioz:
ondorengo erreakzioaren ondorioz:
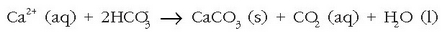
Kaltzio sulfatoa ere hauspeatu egiten da, bere disolbagarritasuna baxuagoa baita ur berotan ur hotzetan baino. Kafeontzi, teontzi eta berotze-sistemetako hodietan agertzen den hauspeakin ezagun hori kaltzio karbonato eta kaltzio sulfatozko nahastea da. Hauspeakin hau, denbora luzez utziz gero, piskanaka-piskanaka hodiak ixtera irits daiteke.
Prozesua euriarekin hasten da, ur honek karbono dioxidoa baitu disolbaturik eta ondorioz az. karbonikoa ere bai:
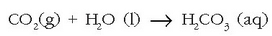
Ura lurraren gainazaletik eta lurrazpitik igarotzean, azido karbonikoak kararrien kaltzio karbonatoarekin erreakzionatzen du eta disolbagarriagoa den hidrogeno karbonatoa ematen:
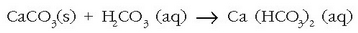
Baina erreakzio hau atzeruntz doa zerbaitegatik ura berotutakoan (kafeontzi batean, …):
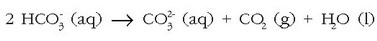
karbono dioxidoak ihes egingo du (gasa baita) eta karbonato ioiak disoluzioan geratuko dira, eta kaltzio karbonatoa ia disolbaezina denez, zolda baten moduan hauspeatuko da.
Zer egin daiteke? Ura «bigundu» egin daiteke, hau da, kaltzio eta magnesio katioiak uretatik
desagertarazi. Horretarako sodio karbonatoa 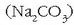 gehitzen zaio urari eta karbonato disolbaezinak hauspeatuko dira:
gehitzen zaio urari eta karbonato disolbaezinak hauspeatuko dira:
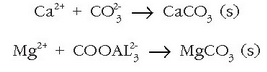
Ura gogortzen duena kaltzio bikarbonatoa besterik ez bada, erraz konpon daiteke arazoa, edo ura irakiten jarri kaltzio karbonatoa hauspea dadin; edo kaltzio oxidoa gehitu kaltzio bikarbonato guztia kaltzio karbonato moduan hauspeatzeko.
Disolbatzailearen eragina disolbagarritasunean
Arau moduan zera erabil daiteke: antzekoak antzekoa disolbatuko du. Disolbatzaile polar batek (ura adibidez) errazago eta hobeto disolbatuko ditu oro har substantzia polar eta ionikoak disolbatzaile ez polar (bentzenoa adibidez) batek baino. Bestalde, isurkari ez polarrak (bentzenoa edo lehorreko garbikuntzan erabiltzen den tetrakloroetilenoa) disolbatzaile egokiagoak dira substantzia ez polarrentzat, polarrentzat baino. Honen arrazoia zera da: solutuaren molekulen energia disoluzioetan, gotor egoeran zuenaren antzekoa izango dela, bietan molekulen arteko indarrak antzekoak baldin badira behintzat. Ad. solutuaren molekulen arteko indarrak hidrogenozko zubiak baldin badira, hobekien disolbatuko duten disolbatzaileak hidrogenozko zubiak dituztenak izango dira. Azukrea berehala disolbatuko da uretan, baina ez bentzenotan.
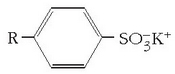
Gertaera bitxia da xaboi edo garbikariena. Hauetan ere «antzekoak antzekoa disolbatuko du» deitu diogun araua baliagarria da. Xaboiak kate hidrokarbonatua luzeko azido organikoen sodio gatzak dira.
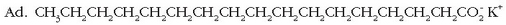
Molekula honek bi zati desberdin ditu: ioi zati polarra (azido taldearena,
 eta adar
luze ez polarra (gainontzekoa). Urdisoluzio batean aurkitzen direnean, katea horien joera
elkarrengana hurbiltzea da, hidrokarburoen arteko van der Waals-en indarren ondorioz
sistemaren energia txikiagoa eginez. Bilkurak esferaitxura du eta esfera horren gainazalean
talde polarrak egongo dira
eta adar
luze ez polarra (gainontzekoa). Urdisoluzio batean aurkitzen direnean, katea horien joera
elkarrengana hurbiltzea da, hidrokarburoen arteko van der Waals-en indarren ondorioz
sistemaren energia txikiagoa eginez. Bilkurak esferaitxura du eta esfera horren gainazalean
talde polarrak egongo dira  .
Kanpoko aldean gelditzen diren karboxilato taldeak urak disolbatatuko ditu edo katioiarekin egonkortuko dira.
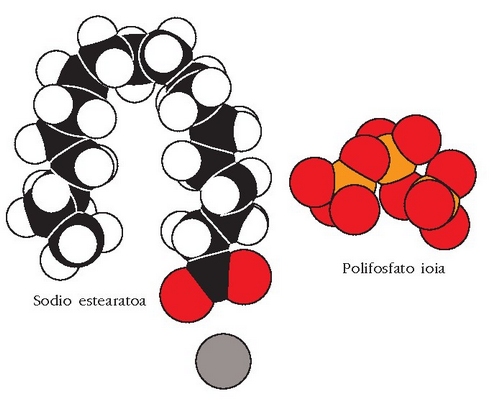
Esfera itxurako egitura honi mizela esaten zaio.
.
Kanpoko aldean gelditzen diren karboxilato taldeak urak disolbatatuko ditu edo katioiarekin egonkortuko dira.
Esfera itxurako egitura honi mizela esaten zaio.
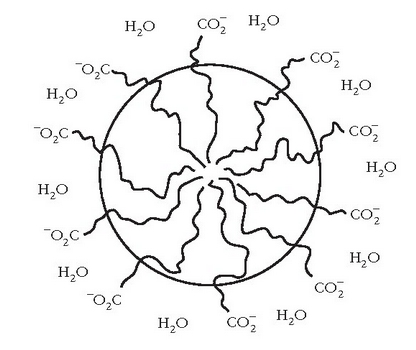
Mizela
Uretan disolbaezina den materia organikoa (ad. gurina edo koipea) mizelaren barnealdean disolba daiteke, han ingurune ez polarra baitago eta mizela uretan dagoenez zikinkeria urarekin joango da.
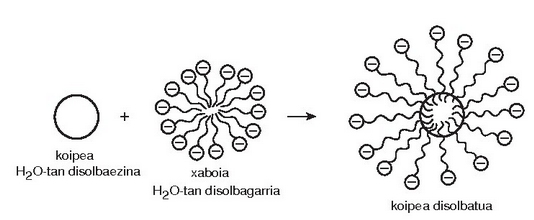
Baina xaboiekin datorren hurrengo arazoa xaboi hondakinen desagertzea da. Badira xaboiak metaboliza ditzaketen bakterio naturalak. Degradazioa azkarragoa da xaboiaren molekularen kate hidrokarbonatua adar gutxikoa baldin bada. Izadian aurkitzen diren azido koipe guztiak adarkatu gabeak dira eta horrexegatik koipe edo gantz naturaletatik lorturiko xaboiak biodegradagarriak direla esan ohi da. Hori horrela izan zen 1933. urtea arte. Urte hartan atera ziren merkatura lehenengo garbikari sintetikoak. Hauen abantaila nagusia zera zen, xaboi naturalekin ur «gogorretan» ateratzen zen «apar» berezia ekiditea. Zer da bada, «apar» bitxi hori? Aparra hauspeakin bat baino ez da, kaltziozko gatzek disolbagarritasun baxuagoa baitute sodiozkoek baino:
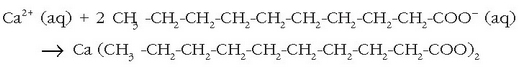
Erreakzio desegoki hau gerta ez dadin, xaboia erabili baino lehen kaltziozko katioiak uretatik desagertaraziko dituen gairen bat gehi daiteke, ad. sodio karbonatoa («washing soda»). Honek kaltzio karbonatozko hauspeakina sortuko du, eta kaltziozko katioiak desagertaraziko ditu uretatik
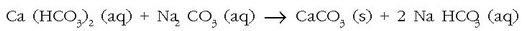
Apar horren arazoa konpontzeko beste modu bat garbikariari berari polifosfatozko ioiak gehitzea da.
Ioi hauek fosfatoak berotutakoan sortzen dira eta nagusiki
 -zko eraztunak eta kateak dira.
Berorien eraketarako lehen urratsa ondorengoa da:
-zko eraztunak eta kateak dira.
Berorien eraketarako lehen urratsa ondorengoa da:
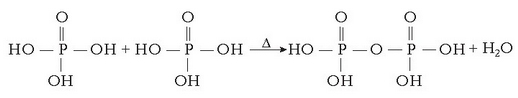
Polifosfatozko ioiak handiak dira eta ur gogorretara gehitutakoan, kaltziozko katioiak inguratu eta beste anioi batzuetatik babesten dituzte. Honela beste anioi horiekin erreakzionatzen ez dutenez ez dago hauspeatze erreakziorik. Ioi batek beste bat inguratu eta babesten duenean ioia «harrapatu» egin duela esaten da (sequestration) eta hori egiten duten ioiei harrapakariak esaten zaie.
Lehenengo garbikari sintetikoak alkilobentzenosulfonatoak ziren eta xaboi naturalen antzera katea ez polarrarekin batera mutur polarra zuten.
Baina garbikari hauen kateak adarkatuak zirenez arazoak agertzen ziren garbikariak degradatzeko garaian eta, «ur beltzak» tratatzen ziren araztegietan, ur beltz tratatuekin batera, garbikariak ateratzen ziren apar moduan, eta berdin ibaietan ere. Arazo honen inguruan ikerkuntza luzea egin ondoren 1965ean garbikari familia berri bat proposatu zen: alkanosulfonato linealena.
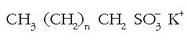
Adarkatzerik gabeko kateak direnez bakterio naturalek ez dute arazorik garbikari sintetiko hauek degradatzeko. Merkatuan saltzen den egungo garbikaria ez da osagai bakarra, nahaste bat baizik. Osagaien artean emultsionatzailea dugu, hau da, xaboi naturalen antzera zati polarra eta ez polarra dituen substantzia. Honekin batera polifosfatoak ere baditu kaltziozko ioiak harrapatzeko eta beste osagairen bat inguruneko pH-a kontrolatzeko. Beste osagai bat fluoreszentzia duena da: argi ultramorea zurgatzen du eta ikuskorra islatzen eta garbitasun txuriagoa lortu den itxura ematen du
Presioaren eragina gasen disolbagarritasunean
Disoluzio isurkarien artean oso ezagunak dira gas isurkari sistemak. Sistema hauetan disolbagarritasunean eragina duen beste faktore garrantzitsu bat presioa da. Gasa errazago disolbatuko da presio handietan txikietan baino. Edari gasdunak dira horren adibide garbiak, nola ur gasduna hala cava. Anhidrido karbonikoa isurkaritan disolbatzerakoan presio handia aplikatzen da (cavaren kasuan botila itxi ondoren gertatuko den hartzidurak eragingo du presio handia). Botila irekitakoan bapatean presioa gutxitu eta disolbagarritasuna txikiagotu egingo da eta hain ezagunak diren burbuilak ikusten dira. Portaera honekin lotutako beste gertakari bat murgilariena da. Murgilariak uretara sartu eta hondoruntz jaisten hasten direnean presioa handitzen doa eta bizkarrean daramatzaten botiletako airea arnasterakoan presioa handiagoa izateagatik gas horien disolbagarritasuna odolean handiagoa egingo da. Nitrogenoaren kasuan disolbagarritasuna dexente handitzen da eta bapatean murgilaria ur azalera itzuliko balitz, nitrogenoaren disolbagarritasuna txikiagotu eta burbuilak sortuko lirateke odol korrontean. Burbuila horiek kapilar txikiak itxi ditzakete eta ehunek beharrezkoa duten oxigenorik gabe utzi. Hau gertatuz gero apoplejia deritzona gerta daiteke eta zenbait kasutan heriotza ekar dezake. Arazo hau konpontzeko aire-botiletan helioa nahasten da oxigenoarekin nitrogenoaren ordez, helioaren disolbagarritasuna askoz ere txikiagoa delako.
Gas isurkari sistemetan disolbagarritasuna eta presioa lotzen dituen erlazioa, William Henry kimikari ingelesak aurkitu zuen 1801ean. Isurkari batean gas batek duen disolbagarritasuna bere presio partzialaren proportziozkoa da. Horixe bera da Henry-ren legea:
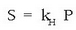
S disolbagarritasuna, 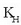 Henry-ren konstantea eta P gasaren presio
partziala izanik. Henry-ren konstantea faktore askoren mende
dago, hala nola, gasa mota, disolbatzailea, tenperatura…
Henry-ren konstantea eta P gasaren presio
partziala izanik. Henry-ren konstantea faktore askoren mende
dago, hala nola, gasa mota, disolbatzailea, tenperatura…
Tenperaturaren eragina disolbagarritasunean
Tenperatura igotzean gas guztien disolbagarritasuna txikiagoa egiten den bezala, gotor gehienak errazago disolbatzen dira ur berotan ur hotzetan baino. Gai batetik bestera asko aldatzen da disolbagarritasuna eta zenbait kasutan portaera bikoitza izan dezakete, hots, tenperatura bateraino disolbagarritasuna handitu eta hortik aurrera txikiagoa egiten hasi.
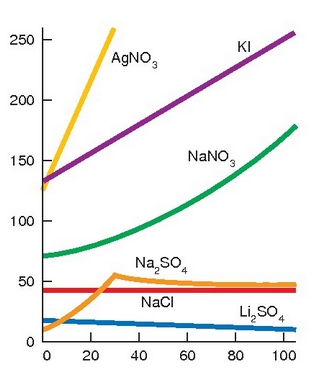
Gatz ezberdinen disolbagarritasuna uretan nola aldatzen den tenperaturarekin
Gasen disolbagarritasuna, aldiz, beste era batera aldatzen da tenperaturarekin. Honen adibide bat etxeko kanilean dago, kanileko ur hotza ontzi batean gela beroago batean utziz gero, uraren gainazalean burbuila txikiak agertu ohi dira, hau da, ur hotzetan disolbaturik zegoen airea, hain zuzen ere. Tenperaturaren eragina oso garrantzitsua da uretan bizi diren animalia eta landareetan eta efektu honi kutsadura termikoa esaten zaio. Lantegi askotan ura erabiltzen da hozte prozesuetan eta ibaira itzultzen den ura ur beroa izaten da. Ur berotan oxigenoaren disolbagarritasuna txikiagoa denez arazoak ekartzen ditu uretan dauden bizidunentzat. Gainera ur beroaren dentsitatea txikiagoa denez gaineko geruzatan geldituko da eta ez dio utziko oxigenoari beheko geruza hotzetara pasatzen.
Kontzentrazioa
Disoluzio bat zehazteko ez da nahikoa osagaiak zeintzuk diren esatea, osagai horiek zein proportziotan aurkitzen diren ere esan beharko da. Ez dira berdinak izango bi disoluzio, batean litro bat uretan 50 g gatz baldin badago eta bestean berriz 100 g gatz. Baina aldiz, guztiz berdinak izango dira batean litro bat uretan 50 g gatz baldin badago eta bestean 100 g gatz 2 litro uretan. Bi hauetan kantitatea ez baino, osagaien arteko proportzioa da berdina, hau da, kontzentrazioa. Magnitude hori erabiliko dugu disoluzio bat zehazteko. Modu asko daude kontzentrazioa adierazteko.
Ehunekoa pisuan: 100 g disoluziotan zenbat gramo solutu dagoen adierazteko. Oso unitate erabilia da, guztiz erosoa baita kalkulatzeko; bi osagaiak nahastu aurretik pisatu eta kitto. Ad. 50 g gatz eta 100 g ur: (50/150 ).100 = % 33,3 Kalkulu kimikoak egiteko ez da oso unitate egokia, kalkulu estekiometrikoak egin ahal izateko mol kopuruak hartu behar direlako kontuan.
Ehunekoa bolumenean: unitate mota hau erabiliagoa da gas disoluzioetan edo bi
isurkariren disoluzioetan. Disoluzioaren 100 bolumen unitatetan
(litro,  , …)
zenbat bolumen unitate solutu disolbatu den adieraziko du.
Ad. alkohola %80koa dela esaten denean disoluzioaren
, …)
zenbat bolumen unitate solutu disolbatu den adieraziko du.
Ad. alkohola %80koa dela esaten denean disoluzioaren
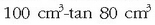 alkohol dagoela esan nahi da.
alkohol dagoela esan nahi da.
Gramoak litroko: solutua gotorra izanda isurkari batean disolbatzen denean gehien erabiltzen den unitatea da. Litro bat disoluziotan zenbat gramo solutu dagoen adierazten du. Ad. 50 g gatz litr o bat uretan: 50 g/1 l = 50 g/l.
Baina kalkulu kimikoak egiteko ez da jakin behar zenbat gramo solutu edo zenbat litro disolbatzaile dauden. Askoz ere erabilgarriagoa da zenbat mol dauden jakitea. Erreakzioetan eskuarki solutua da parte hartzen duena eta horregatik kontzentrazioa adierazteko modu askok solutuaren mol kopurua adierazten dute disolbatzailearen bolumenean, edo disoluzioaren bolumenean edo disolbatzailearen masa kantitate batean.
Molaritatea: edo mol kontzentrazioa. Disoluzio baten molaritatea disoluzio litroko dagoen solutu mol kopurua da.
Ad. 25 g NaCl disolbatu nahi dira uretan 2 litro disoluzio izan arte. Zein izango da mol kontzentrazioa? NaCl-ren pisu molekularra kalkulatu behar da:
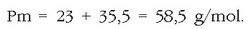
Solutuaren mol kopurua hauxe izango da:
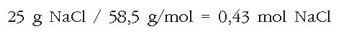
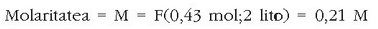
Normaltasuna: lege ponderalak ikusi genituenean, atomoek elkarrekin erreakzionatzean proportzio jakin eta finkoetan egiten zutela ikusi genuen. Oxigenoa edo hidrogenoa oinarritzat harturik, hauekin erreakzionatuko luketen gainontzeko gaien pisuak oso erabiliak dira kimikan eta pisu baliokidea esaten zaiona definitzeko aukera ematen dute. Edozein gairen pisu baliokidea zera izango da: 7,999 g oxigenorekin edo 1,008 g hidrogenorekin erreakzionatuko duen gai horren masa. Pisu baliokidea definitu ondoren baliokide kopurua lor daiteke. Kloroaren pisu baliokidea 35,5 da (71 g klorok 2 g hidrogenorekin erreakzionatzen baitute) eta beraz, 35,5 g da kloroaren baliokidea.
Disoluzio baten kontzentrazioaren berri emateko baliokide kopuruak adierazten direnean, normaltasuna deritzo erabilitako kontzentrazio motari.
Normaltasuna = F(solutuaren baliokide kopurua;disoluzioaren litro batean) = N
Molalitatea: disolbatzaile kilogramo batean disolbatutako solutu mol kopurua adierazten du. m hizkiaz adierazi ohi da. Molalitatea oso erabilia da tasun koligatiboetan.
1 l disoluzio eta 1 kg disolbatzaile (uraren kasuan) ez dira gauza bera izango, baina disoluzioa diluitu samarra baldin bada, askotan pareka daitezke eta honenbestez molaritatea eta molalitatea ia berdinak lirateke.
Zatiki molarra: solutuaren mol kopurua disoluzioaren guztizko mol kopuruaren artean zatikatzean lortzen da. Avogadroren zenbakiari esker, molekula kopurua edo mol kopurua erabiltzea, kasu honetan, gauza bera da (zatiketa bat egin behar baita).
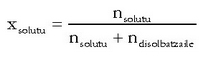
Mol partikula definitu den moduagatik gehienez har dezakeen balioa 1 izango da (ez dago beste osagairik disoluzioan), eta txikiena 0 (osagai horretatik ez dago ezer). Disoluzioaren osagai guztien mol partikulak kalkulatu ondoren batuketa eginda, baturak beti 1 eman behar du.
Milioi bakoitzeko zatiak: unitate mota hau solutu kantitate oso txikiak daudenean erabiltzen da. Ad. ur edangarrian onar daitekeen metal kantitatea, airearen kutsadura adierazteko, …

Tasun koligatiboak
Neguan autoei izotz-kontrako isurkaria botatzen zaie erradiadoreetako ura izoztu ez dadin. Denok ikusi dugu negu hotzean err epideetan gatza nola botatzen den izotz hormak deusezteko. Bestalde, sustraietatik sartutako ura goraka doa etengabe zuhaitzen hostoetara iritsi arte nahiz 100 m-ko altuera igo behar izan. Globulu gorriei ur destilatua sartzen bazaie lehertu egiten dira.
Gertaera hauek guztiek bitxiak eta elkarren arteko erlaziorik gabeak badirudite ere, denak tasun berdinetan oinarritzen dira, disoluzioen propietate koligatiboetan, hain zuzen ere. Izen hori eman zaie solutu eta disolbatzaile partikulen araberako tasunak direlako, eta ez osagaien izaeraren araberakoak.
Tasun koligatiboak ondorengoak dira: lurrin presioaren beherakada, irakite tenperaturaren gorakada, fusio tenperaturaren beherakada eta presio osmotikoa.
Lurrin presioaren beherakada
Solutu ez lurrinkorra disolbatzaile batean disolbatutakoan disoluzioak izango duen lurrin presioa baxuagoa izango da disolbatzaile soilarena baino. Ad. sodio klorurozko ur disoluzio batek (0.1 M) 40 ºC-tan 44 mm Hg-tako lurrin-presioa du eta ur hutsak, aldiz, tenperatura horretan 55 mm Hg-tako lurrin presioa du. François Marie Raoult zientzilari frantziarrak (1830-1901) bere bizitzaren erdia lurrin presioak neurtzen pasa zuen eta azkenean bere ondorioa Raoult-en lege moduan ezagutzen den honetan laburbildu zuen:
«Solutu ez lurrinkor baten disoluzioaren lurrin presioa disolbatzailearen mol partikularen araberakoa da:
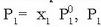 disoluzioaren lurrin presioa,
disoluzioaren lurrin presioa,
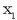 disolbatzailearen mol partikula
eta
disolbatzailearen mol partikula
eta 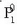 disolbatzaile
soilaren lurrin presioa izanik.»
disolbatzaile
soilaren lurrin presioa izanik.»
Zergatik gertatzen da beherakada hau? Disoluzioa dugunean eta solutua ez lurrinkorra baldin bada, isurkariaren gainazaleko leku batzuk solutuz beteta egongo dira eta horrek oztopatu egingo du disolbatzailearen molekulek lurrinera ihes egitea. Baina solutu molekula horiek ez dute inongo eraginik lurrinetik isurkarira datozen molekuletan eta horrexegatik lurrintze lastertasuna txikiagotu eta isurkaritze lastertasuna berdin mantentzen baldin bada, ondorioa lurrin presioa txikiagoa egitea da.
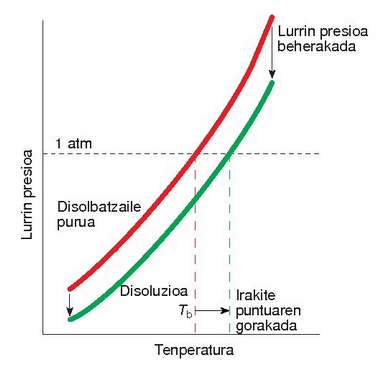
Lurrin presioaren beherakadaren lehenengo ondorioa irakite tenperaturaren gorakada da.
Irakite puntuaren gorakada
Irakite puntua lurrin presioaren araberakoa da, hots, lurrin presioa 1 atm-koa egiteko zer tenperatura behar den, horixe da irakitepunutua. Beraz, disoluzio baten lurrin presioa txikiagoa egiten baldin bada disolbatzailearena baino, gehiago berotu beharko da bere lurrin presioa 1 atm-koa egin arte. Nolanahi ere, irakite puntua oso gutxi igotzen da, ad. azukrezko ur disoluzio baten kontzentrazioa 0.1 M denean irakite puntua 100,1 ºC da
Irakite puntuaren gorakada solutuaren molekula kopuruaren araberakoa da eta honela idazten da:
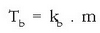
 irakite puntuaren aldaketa,
kb disolbatzailearen araberako konstantea,
eta m disoluzioaren molalitatea izanik.
irakite puntuaren aldaketa,
kb disolbatzailearen araberako konstantea,
eta m disoluzioaren molalitatea izanik.
Gertaera honetan oinarrituz jakiak azkarrago egosi nahi baldin badira, sukaldari askok badakite gatza uretara botaz irakite puntua igo eta jakiak azkarrago egosiko direla. Irakite puntuaren neurketak eginez pisu molekular ezezaguneko gaien pisu molekularra lor daiteke.
Fusio puntuaren beherakada
Irakite puntuarekin gertatzen den bezalatsu, disolbatzaile bati solutu ez lurrinkorra gehitutakoan disoluzioa tenperatura baxuagoan hasiko da gotor bihurtzen disolbatzaile soilarekin erkatuz gero. Ad. itsasoko uraren fusio puntua baxuagoa da ur destilatuarena baino. Neguan, leku hotzetan, errepideetan gatza botatzen da elurraren fusio puntua jaisteko, horrela ez baitira hain erraz izotz hormak eratzen. Zergatik da hori? Disolbatzaile hutsa dugunean, bere fusio puntuan isurkaritik ihes egin eta gotor egoerara pasatzen den molekula kopurua denbora unitatean eta gotorretik aterata isurkarira itzultzen den molekulen lastertasuna berdinak dira. Isurkarian solutua dagoenean, gotorra ukitzen dauden disolbatzailearen molekula kopurua txikiagoa izango da, leku batzuk solutuak hartuta izango baititu. Horregatik bi lastertasunetatik bat txikiagoa egiten denez oreka apurtu eta oreka hori tenperatura baxuagoan berreskuratuko da. Irakite puntuaren antzera, orain ere fusio puntua zenbat jaitsiko den disoluzioan dagoen solutu kantitateak finkatuko du, eta ez solutu motak.
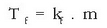
Fusio puntuaren beherakada solutuaren pisu molekularra lortzeko ere erabil daiteke. Gertaera honen beste erabilera bat gaien araztea da. Disoluzio bat gotortzen hasten denean disolbatzailea soilik gotortuko da eta gelditzen den disoluzioa geroz eta kontzentratuagoa izango da. Prozesuak horrela jarraituko du disolbatzaile guztia gotortu arte. Metodo hau erabili izan da disolbatzaileak arazteko, edota silikona guztiz purua lortzeko (erdieroaleetan erabili ahal izateko).
Presio osmotikoa
Behar bada osmosia da tasun koligatiboen artean garrantzitsuena, nola bizitzarako, hala laboratoriorako. Demagun xafla mehe bat dugula eta molekula edo partikula batzuek zeharkatu badezakete ere, beste batzuentzat iragazkaitza dela. Xafla horri erdi iragazkorra esango diogu eta mintza deituko diogu. Bizidunen zelulen hor - mak mintzak dira eta partikula batzuei pasatzen uzten dieten bitar - tean beste batzuei ez diete uzten. Mintzaren bi aldeetan kontzentrazio bereko isurkaria edo likidoa jarriz gero ez dugu kanpotik inongo aldaketarik ikusiko denboran zehar, aldiz, alde batean isurkari purua eta bestean isurkari horren disoluzio bat baldin badaude, denbora pasatu ahala bi aldeetako kontzentrazioa nola aldatuko den ikusiko dugu. Mintzak disolbatzaileari pasatzen utziko dio baina ez solutuari. Mintza jarri ondoren nahiko denbora itxaronez gero, disolbatzaile purua zegoen lekuan orain disolbatzaile gutxiago dagoela ikusi ahal izango da eta beste aldean berriz maila nola igo den. Orain mintzaren bi aldeetan ez da presio berdina egongo, disoluzioaren gainean presio handiagoa izango da beste aldean baino. Orekara iritsi ondoren bi aldeen artean dagoen presio aldaketa da presio osmotikoa ( ).

Azenario bat zulatu eta gatz disoluzio koloreztatu batez bete da. Azenarioaren goiko aldea tapoi batez itxi da eta tapoiari ori luze estu bat jarri zaio. Azenarioa uretan sartzen denean, disoluzioa hodian gora igotzen hasten da, nahikoa gora gainera. Azenario zelulek mintz erdi irazkor gisa jokatzen dute: ura osmosi bidez gatz disoluziora sartzen da; disoluzio hori ur horretan nahasten da eta bolumena handitu egiten da horrenbestez. Bolumen handitzearen ondorioz disoluzioa hodian gora igotzen da
van’t Hoff-ek presio osmotikoa disoluzioaren kontzentrazioarekin lotzen duen adierazpena lortu zuen:
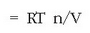
n solutuaren mol kopurua eta V disoluzioaren bolumena izanik. Presio osmotikoa oso zehatza da pisu molekularrak neurtzeko eta oso erabilia proteinen eta polimeroen pisu molekularrak lortzeko
Gainera giro tenperaturan lan egiteko aukera ematen du, eta pr oteinen kasuan adibidez, tenperatura igo beharrik ez izatea oso garrantzitsua izan daiteke (ikus proteinen desnaturalizazioa). Presio osmotikoa da ura zuztarretatik gora hostoetara igoarazten duena edo globulu gorriak uretan murgildutakoan lehertzearen arrazoia
Osmosiaren erabilera bitxiak
Zelularen paretak mintz erdi irazkorrak dira: ura, molekula txiki batzuk eta ioi hidratatuak sar daitezke haietan zehar gorputzera, baina zelula barnean sintetizatu berri diren entzimei eta proteinei, berriz, ez diete irteten uzten. Landareen zeluletan solutuaren kontzentrazioa handia denez, ura kanpotik barrura igarotzen da, elikagaiak eramanez. Sartzen ari den ur horrek guri eta sendo mantentzen du zelula. Landarea moztean, ez da ur gehiago sartuko, zelulak zimeldu egingo dira, eta landarearen itxura erabat aldatuko da. Okela gazitzea ere —hala bakterioek eraso egin ez diezaioten— osmosiaren beste adibide bat da. Kasu horretan gatz disoluzio kontzentratu horrek bakterioa deshidratatuko du, bakterioetatik ura ateraraziko baitu.
Odoleko globulu gorrien itxura ere osmosiari zor zaio. Globulu horien paretak irazgaitzak dira sodio ioientzat; horregatik, ioi horien kontzentrazioa paretaren edozein albotan aldatuko balitz, osmosia gertatuko litzateke. Zelulen inguruko plasman sodio katioien kontzentrazioa txikia denean, ura globuluetara sartuko da, eta jario horrek globulua lehertu arte jarrai dezake. Odol kapilarretako hormak ere mintz erdi irazkorrak dira: gai guztiak igarotzen uzten dituzte, proteina luzeak izan ezik. Horrenbestez, proteina horiek odol plasman agertzen baldin badira, ur jarioa kontrolatuko dute kapilarren paretetan zehar. Plasman dauden proteinen kontzentrazioa urritzen bada (gose greba batean, adibidez), ura kapilarretara igaroko da. Hori eragozteko (eta, agian, bizia salbatzeko) proteinetan aberatsa den odol plasma txertatu behar da.
Osmosiaren garrantzi handiko beste erabilera bat alderantzizko osmosia da; disoluzioa dagoen mintz erdi irazkorraren aldean presio osmotikoa baino handiagoa aplikatzen datza, eta, besteak beste, itsasoko ura edateko ur bihurtzeko erabiltzen da. Kanpoko presio horrek ura disoluziotik disolbatzaile purua dagoen lekura igaroaraziko du. Arazoa mintzek oso-oso presio handia jasan behar dutela da; zelulosa azetatozko mintzak erabiltzen dira, eta 70 atm-ko presioa jasan dezakete. Mintz horren metro kubiko bakoitzeko 250.000 litro ur garbi lor daiteke egunean.