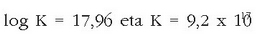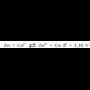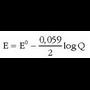Fisika-Kimika»Fisika - Kimika
Elektrokimika
Galvaniren pilak
Erredox erreakzioetan, elektroi transferentzia gertatzen da gai batetik bestera, erreduzitzailetik oxidatzailera. Transferentzia hori zuzenean gertatzen da inongo bitartekorik gabe. Galvaniren piletan elektroi transferentzia ez da zuzenean gertatzen, kanpo zirkuitu baten bidez baizik.
Oso erredox erreakzio ezaguna da zink metalikoa kobre sulfatozko disoluzio batean sartzen denean gertatzen dena. Kobre sulfatozko disoluzioa urdina izanik, kolorea ahultzen joaten zaio poliki-poliki, garbi antz ematen zaiola. Oraindik errazago ikusten da metalezko zinka gorritu egiten dela, gainean metalezko kobrea hauspeatzen delako. Ondorengo erreakzioa gertatzean da:
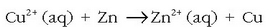
Zinka kobre ioiarekin batera jarri denean erredox erreakzioa gertatu da.
Zinkak elektroiak askatzen ditu, 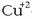 -ak har ditzan.
Baina nola hartutakoan metalezko Cu bihurtzen den eta zinkaren gainean jalki, erreakzioan parte hartu duten elektroiek
zinkezko xaflatik ez dutela alde egin esan daiteke.
-ak har ditzan.
Baina nola hartutakoan metalezko Cu bihurtzen den eta zinkaren gainean jalki, erreakzioan parte hartu duten elektroiek
zinkezko xaflatik ez dutela alde egin esan daiteke.
Galvaniren pila baten bitartez bereizten dira fisikoki esandako erreakzioko erdi erreakzioak (ikus irudia).
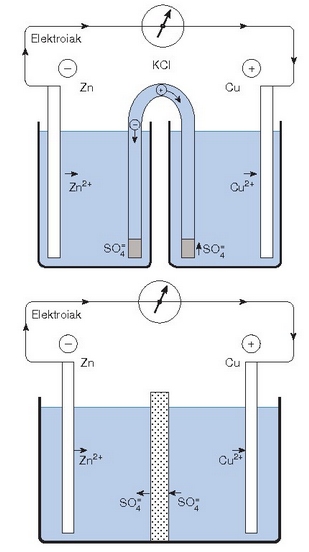
Daniell-en pila. Goian, gatz-zubiaren bidez lortzen da kontaktu elektrikoa. Behean, pareta porotsuarekin egiten da kontaktua
Ikusten den bezala Zn-a ez dago zuzenan
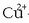 -a ukitzen duela,
baizik eta zirkuitu baten bitartez. Zinkak askatu behar dituen elektroiak zirkuituan zehar helduko dira
-a ukitzen duela,
baizik eta zirkuitu baten bitartez. Zinkak askatu behar dituen elektroiak zirkuituan zehar helduko dira
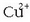 ioiak dauden aldera,
galvanometro baten bidez ikus daitekeen bezala. Horrela eraikitako Galvaniren pilari Daniell-en pila esaten zaio,
asmatzailearen omenez.
ioiak dauden aldera,
galvanometro baten bidez ikus daitekeen bezala. Horrela eraikitako Galvaniren pilari Daniell-en pila esaten zaio,
asmatzailearen omenez.
Prozesu biak ongi bereizita daude irudian, ontzi banatan gertatzen direlako. Ontzi batean (ezkerreko aldean) oxidazioa gertatuko da:
 oxidazioa
oxidazioa
Eskuineko aldean, berriz, erredukzioa:
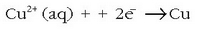 erredukzioa
erredukzioa
Prozesu biak ontzi berean ere burutu daitezke, baina orduan beharrezkoa da pareta porotsu baten bidez bereiztea (irudia).
Ontziak desberdinak direnean zirkuitua ixteko gatzezko zubia esaten zaiona jartzen da. Eskuarki, beirazko hodi bat izaten da
elektrolitozko disoluzio kontzentratu batez betea  Nola modu batera hala bestera disoluzioen nahastea galerazten da, baina ez zaio eragozpenik jartzen ioien garraioari.
Nola modu batera hala bestera disoluzioen nahastea galerazten da, baina ez zaio eragozpenik jartzen ioien garraioari.
Pila guztietan, beraz, elektroiak kanpo-zirkuituan zehar garraiatzen dira elektrodo negatibotik positibora. Elektrodo negatiboari anodoa esaten zaio eta katodoa elektrodo positiboari. Barne-zirkuitu likidotik berriz, ioiak garraiatzen dira.
Bestalde, pilak funtzionatzerakoan, Zn-zko xaflak pisua galtzen du, zenbait atomo disoluziora pasatzen direlako,
 eran. Kobrezko xaflak, ostera, pisua irabazten du, bertan disoluzioko
eran. Kobrezko xaflak, ostera, pisua irabazten du, bertan disoluzioko
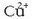 ioiak hauspeatu direlako, metalezko Cu eran.
ioiak hauspeatu direlako, metalezko Cu eran.
Disoluzio anodikoa, gainera,
 ioiz aseko da, katodikoak
ioiz aseko da, katodikoak
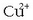 ioiak galtzen dituen neurrian.
Hala bada, tarte baten ondoren pila agortu egingo da.
ioiak galtzen dituen neurrian.
Hala bada, tarte baten ondoren pila agortu egingo da.
Honelaxe adierazi ohi da Daniell-en pila:
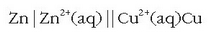
Ezkerreko aldean elektrodo negatiboa jartzen da beti.
Gasezko elektrodoak
Daniell-en pila, disoluzio banatan murgildutako bi elektrodo gotor edo solidoez eratuta dago. Baina elektrodoak gasezkoak ere izan daitezke, hau da, erredox prozesuan parte hartzen duen elementua gasa izan daiteke (kloroa, oxigenoa, hidrogenoa…)
Ondoko irudian, elektrodo bat nikelezkoa eta bestea klorozkoa dituen Daniell-en pila ikus daiteke. Nikela metal gotorra da, elektrodo normala beraz; bestea berriz, gasezko elektrodoa da bere osagai nagusia kloroa delako.
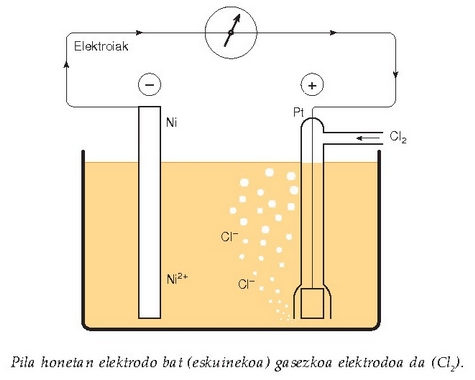
Gasezko elektrodoaren beirazko hodia –bi irteeraduna– disoluzioan murgilduta dago. Goiko irteeratik elektrodoa osatuko duen gasa sartzen da (adibidean kloroa). Besterik ez balego kloroak alde egingo luke beheko irteeratik. Hori gerta ez dadin, hodiaren barruan xafla batez amaitzen den metalezko haria sartzen da, platinozkoa, eskuarki. Kloroa zurgatu egiten du platinozko xaflak eta eutsi egiten dio, alde egin ez dezan. Platinozko elektrodo honi elektrodo inertea esaten zaio, bere eginbehar bakarra gasari eustea delako, inongo erreakziorik sortu gabe.
Nikelezko elektrodoa polo negatiboa da eta klorozkoa positiboa. Pila honetan ez da beharrezkoa gatz-zubirik edo paretarik jartzea, Cl - ioiek ahalmenik ez dutelako nikelezko xaflatik elektroiak hartzeko. Hona pilaren adierazpena:
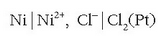
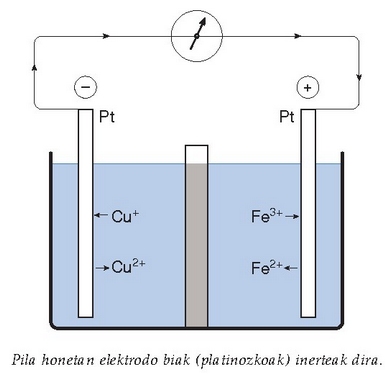
Elektrodo inerteak ez dira bakarrik horrelako elektrodoetan erabiltzen. Erreakzioan parte ez hartzea nahi den guztian erabiliko dira. Gasezko elektrodoak izan gabe, elektrodo inerteak dituen pila ikus daiteke irudian.
Honelaxe adieraziko da:
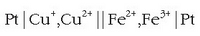
Eta gertatzen den erreakzioa ondokoa izango da:
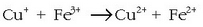
Elektrodo inerteekin egingo da pila hau ere:
Elektrodoen potentzialak
Pila egiteko behar-beharrezkoa da oxidazio eta erredukzio prozesuak ondo bereiztea; bata elektrodo batean gertatuko da eta beste erreakzioa beste elektrodoan. Ba ote dute izaerarik elektrodoek elkarrengadik aldenduta? Neur ote daitezke elektrodoen potentzialak? Elektrodoen potentzialak jakinda, kalkula ote daiteke beroriekin egindako pilaren potentziala edo indar elektroeragilea.
Pilaren indar elektroeragilea edo potentziala, E, desberdina izango da, elektrodo erreakzioetan parte
hartzen duten gaien eta kontzentrazioen arabera. Kontzentrazioak 1M direnean, potentzial normala,
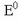 , edo indar elektroeragile normala lortuko da.
Daniellen pilan, adibidez, bai
, edo indar elektroeragile normala lortuko da.
Daniellen pilan, adibidez, bai 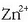 -aren bai
-aren bai
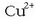 -aren kontzentrazioak 1 M- koak badira,
horiekin egindako pilaren indar elektroeragilea normala izango da:
-aren kontzentrazioak 1 M- koak badira,
horiekin egindako pilaren indar elektroeragilea normala izango da: 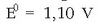
Pilan gertatzen den erreakzioa bi prozesutan bana daitekeen bezala –pilaren elektrodo-erreakzioetan– antzera egin daiteke indar elektroeragilearekin, hau ere bitan banatuz.
Nola neur daitezke, ordea, elektrodoen potentzialak? Berez, ezin burutu daitekeen prozesua da. Arazoa gainditzeko, potentziala neurtu nahi zaion elektrodoa beste elektrodo batekin elkartu, pila bat osatu eta honen indar elektroeragilea neurtuko da.
Baina hori lehenengoaren bigarrenarekiko potentzial erlatiboa izango da. Beraz ezinezkoa da elektrodoen potentzialak neurtzea, potentzial erlatiboak ez bada.
Potentzial erlatiboak neurtzeko beti erreferentzia bera hartzen da, hau da, hidrogenozko elektrodo normala.
Hau gasezko elektrodoa baino ez da: platinozko xafla du (elektrodo inertea)
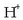 kontzentrazioa 1M duen disoluzioan murgilduta
eta 1 atm-ko presioan dagoen gas hidrogenoa ukitzen duela. Honelaxe adieraziko da elektrodo hau:
kontzentrazioa 1M duen disoluzioan murgilduta
eta 1 atm-ko presioan dagoen gas hidrogenoa ukitzen duela. Honelaxe adieraziko da elektrodo hau:
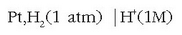
Elektrodo horretan gertatzen den erreakzioa –berarekin elkartzen den elektrodoaren arabera– hauxe izango da:
Anodoa denean:
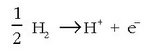
Ala beste hau:
Katodoa denean:
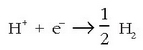
Elektrodo baten potentzial erlatiboa neurtzeko bi datu hauek behar dira:
1.- Elektodoak eta hidrogenozko elektrodo normalak osatutako pilaren indar elektroeragilea.
2.- Potentziala neurtu nahi zaion elektrodoa positiboa ala negatiboa den jakin. Lehenengo neurritik elektrodoaren potentzialaren zenbakizko balioa lortuko da. Bigarrenetik potentzialaren zeinua.
Zinkaren edo kobrearen elektrodoaren potentzial normala neurtu nahi bada, pilak egingo dira hidrogenozko elektrodo normalekin. Osatutako pilen indar elektroeragileak 0,76 V-koa eta 0,34 V-koa dira, hurrenez hurren. Baina lehenengoan zinka polo positiboa den bitartean bigarrenean kobrea polo negatiboa da.
Honelaxe idatziko dira pila biak, polo positiboa beti eskuineko aldean idazten dela:
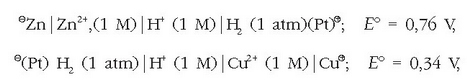
Beraz elektrodoen potentzial normalak hauexek izango dira:
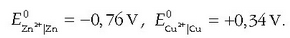
Piletan gertatzen diren erreakzioak ondorengoak izango dira:
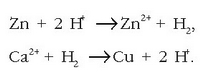
Ondoko taulan zenbait elementuren erredukzio-potentzial normalak ematen dira. Zeinu negatiboak adierazten du erredukzio-erreakzioa ez dela berez gertatzen, alderantzizko erreakzioa baizik. Zenbat eta handiago izan erredukzio-potentziala, orduan eta handiagoa izango da elektrodoaren erreduzitzeko joera, hau da, oxidazioa eragiteko ahalmen handiagoa izango du. Fluoroari dagokio taulan baliorik handiena eta potasioari txikiena. Fluoroa erraz erreduzitzen den bitartean potasioari asko kostako zaio.
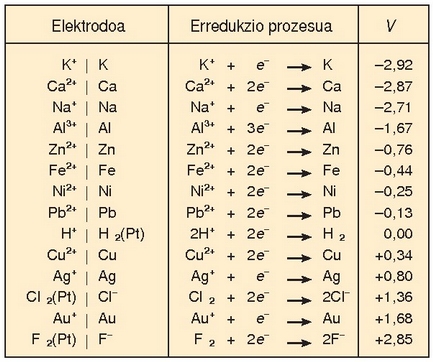
Taulan emandako datuekin erraz kalkula daiteke pila baten indar elektroeragilea eta erraz iragar daiteke elektrodoen polaritatea. Horretarako elektrodoaren erreakzioak idatzi besterik ez dago, bakoitzari dagokion zeinuarekin.
Polo negatiboa erredox-potentzial txikiena duena izango da eta horrek askatuko ditu elektroiak besteari emateko. Polo positiboa, ostera, potentzial handiena duena izango da eta honek jasoko ditu besteak askatutako elektroiak. Pilaren indar elektroeragilea bien batuketa izango da.
Zinkaren eta kobrearen elektrodo normalez osatutako pilaren indar elektroeragilea kalkulatzeko, elektrodo bakoitzean gertatzen den erreakzioa idatziko da, potentzialarekin batera erreakzioari dagokion zeinuarekin:
Elektrodo negatiboa: 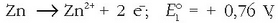
Elektrodo positiboa: 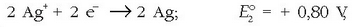
Erreakzio osoa: 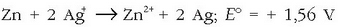
Burdinazko eta aluminiozko bi elektrodo normalekin pila bat egin da. Elektrodoen polaritatea jakin nahi badugu taulara joko da, eta aluminioaren potentzial normala txikiagoa dela ikusiko dugu burdinarena baino. Aluminioa, beraz, polo negatiboa izango da eta burdina positiboa:
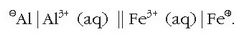
Humphrey Davy
Cornwalleko baserri batean jaio zen (Ingalaterran). Hamasei urte zituela hil zitzaion aita, zituen diru gehienak meatze prospekzio batean xahutu ondoren. Etxera jornala eraman beharrean aurkitu zenez, botikari aprendiz sartu zen. Garai honetan asko irakurri eta estudiatu zuen. Berak erabaki zuen ikasketa egitaraua: teologia, geografia, medikuntza, logika, hizkuntzak (ingelesa, frantsesa, latina, grekera, italiera, gaztelera eta hebraiera), fisika, mekanika, erretorika eta oratoria, historia eta matematikak.
19 urte betetzeko zorian zegoela kimika ikasten hasi zen eta horretarako Lavoisierren Traité Elementaire de Chimie ospetsua irakurri zuen. Berehala, kimikan beste heziketarik jaso gabe, Lavoisierren teoriak frogatzen hasi zen berak egindako tresnak erabiliz. Esperimentu asko egin zuen aldi horretan. Horietako batean frogatu zuen landareek argitan karbono dioxidoa xurgatzen dutela eta oxigenoa askatzen. Gaztea izan arren, konfiantza handia zuen bere buruan, eta garai hartan kimikaren arloan finkatuta zeuden zenbait ideia zalantzan jarri zituen, Lavoisierrenak besteren artean.
1797an, garai hartan aurkitzen ari ziren zenbait gasen sendagarritasuna aztertzen zuen institutu bateko laguntzaile sartu zen Davy. Gas horien artean zeuden oxigenoa, hidrogenoa, karbono dioxidoa eta karbono monoxidoa. Begi bistan dagoenez, gas guztiek ez zituzten eragin onuragarriak izaten institutuko gaixoengan. Davyk gas haiek guztiak arnastu zituen eta, dirudienez, hiltzeko zorian egon zen karbono monoxidoa arnasteagatik. Hasierako esperimentuetako batean, Davyk egiaztatu zuen dinitrogeno oxidoak (N2O) eragin hordigarriak zituela. N2O-ari «gas barreragilea» deitu zitzaion eta klase dirudunek antolatzen zituzten zenbait festa eta dantzalditan modan jarri zen gas hori arnastea. Davyk, ebakuntzak egiteko gas hori erabiltzea proposatu zuen, garai hartan anestesiarik gabe egiten baitziren, eta hala, handik urte batzuetara, dinitrogeno oxidoa dezente erabili zen lehen anestesiatzaile kimiko gisa.
1801ean, 23 urte zituela, orduantxe sortu berri zen Londresko Royal Institution erakundeko zuzendari izendatu zuten. Kimikari buruz eman zituen hitzaldiak oso arrakastatsuak izan ziren eta ospe handia eman zioten Davyri. Hari buruz esan zen zientifiko handi guztien artean «ederrena» zela.
Bere esperimentu garrantzizkoenetako batean, Davyk sodioa eta potasioa prestatu zituen karbonato fundituen elektrolisi bidez, eta metalezko 250 plakaz osatutako bateria eskerga bat erabili zuen horretarako.
1812an, lan gehiegiren erruz guztiz nekatuta, eta ia seguru, kimikako produkturen batek pozoinduta –lanean erabiltzen zituen gai guztiak usaindu eta dastatzeko ohitura zuen, eta gasak zirenean kopuru handiak arnastekoa–, kontua da Davy atseden premia handian zegoela. Royal Intitution erakundean zuen postua bertan behera utzi zuen, eskoziar alargun aberats batekin ezkondu zen eta bira handi bat egin zuen Europan zehar, Michael Faraday laguntzaile zuela. Bidaia hartan, zientifiko ospetsu askorekin izan zituen eztabaidak, geologian eta biologian zenbait oharpen egin zituen eta kimika eta fisikako esperimentuak egiten jarraitu zuen. Davyk arazo praktiko asko konpontzera bideratu zuen bere gaitasuna. Bere asmakizun garrantzitsuenetako bat meatzarientzako segurtasun lanpara (Davyren lanpara) izan zen. Humphrey Davygatik esan izan da, ez zuzentasun handiz beharbada, lorpen handiak egin arren, Michael Faraday izan zela bere aurkikuntza nagusia.
Nola iragarri erredox erreakzioak
Elektrodoen potentzial normalak, ikusi denez, erredukzioa gertatzeko joera erlatiboa ematen du. Potentzial horiek, beraz, erredox erreakzioen noranzkoa iragartzeko erabil daitezke. Horretarako erreakzio osoa bitan banatu behar da. Erredukzio-potentzial handienak emango du erreakzioaren noranzkoa.
a) Gertatuko ote da erreakziorik metalezko zinkaren eta hidrogeno ioien artean? Hona hemen taulatik atera daitekeena:

Hidrogenoak joera handigoa du erreduzitzeko, beraz berau izango da erreduzituko dena:
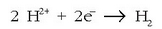
Zinka, ondorioz, oxidatu egingo da:
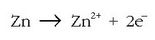
Erreakzio osoa:
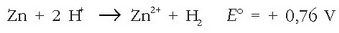
Metalezko zinkak, ondoriozta daitekeen bezala, berez erreakzionatuko du hidrogeno ioiekin eta goiko erreakzioa emango du.
b) Erreakzionatuko ote du metalezko kobreak hidrogeno ioiekin?
Hara zer ateratzen den taulatik:
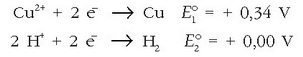
Kobreak du erredukzio-potentzial handiena; beraz, berau izango da erreduzituko dena, oxidatuko den hidrogeno ioien aurrean:
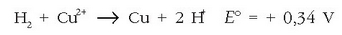
Kobrea eta erredukzio-potentzial handiagoa duten metalak ez dira gai izango hidrogenoa bere azidoetatik tokiz aldatzeko:
 -zko disoluzioa duten ontzi banatan
burdinazko ziria sartu da batean eta zilarrezkoa bestean. Erreakziorik gertatuko den jakin nahi bada taulako
erredukzio-potentzialak jasoko dira, errakzioetan parte har dezaketen metal guztientzat:
-zko disoluzioa duten ontzi banatan
burdinazko ziria sartu da batean eta zilarrezkoa bestean. Erreakziorik gertatuko den jakin nahi bada taulako
erredukzio-potentzialak jasoko dira, errakzioetan parte har dezaketen metal guztientzat:
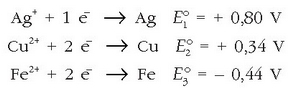
Burdina sartutakoan kobrea izango da erreduzituko dena, berak baitu erredukzio-potentzialik altuena bien artean:
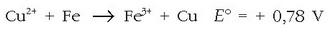
Zilarra sartutakoan, ostera, zilarra erreduzituko litzateke:
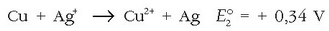
Baina nola metalezko kobrerik inon ez dagoen ez da erreakziorik gertatuko.
Oxida ote daiteke ioduroa –iodoa emanez– potasio dikromatoaren bitartez? Beti bezala potentzial normalak eduki behar dira kontutan. Ondoren ematen dira taulan aurkitutako erredukzio-potentzial normalak:
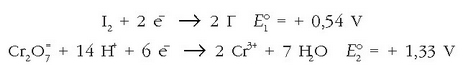
Erredukzio-potentzialik altuena dikromatoak du, beraz bera izango da erreduzituko dena, bestea (ioduroa) oxidatuz:
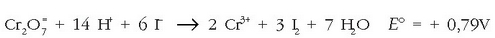
Erreakzio osoarentzat lortzen den potentziala +079 V-koa da; horretaz hauxe esan daiteke: lortzen den potentziala 0,5 V-tik gorakoa denean, erreakzioa erabat eskuineko aldera tokiz aldatuta egongo da.
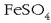 -zko
disoluzio batean zehar
-zko
disoluzio batean zehar 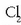 pasarazi da gas eran;
jakin nahi bada
pasarazi da gas eran;
jakin nahi bada 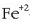 -a oxidatuko den ala ez,
erredukzio bakoitzaren potentzial normala jakin beharko da:
-a oxidatuko den ala ez,
erredukzio bakoitzaren potentzial normala jakin beharko da:

Kloroa izango da erreduzituko dena Fe +2 -aren aurrean, erreakzio hau emanez:
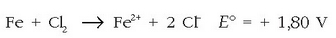
Elektrolisia
Galvaniren piletan erreakzio kimikoak –erredox erreakzioa izan behar du, nahitaez– korronte elektrikoa ematen du. Gerta ote daiteke alderantzizko prozesua? Korronte elektriko batek sor ote dezake erreakzio kimikorik?
Elektrolitoen disoluzioak, gauza jakina da, korronte elektrikoaren eroaleak dira baina eroateko era ez da metalean gertatzen dena bezalakoa, hauetan elektroi emari hutsa gertatzen baita eta haietan ioiak dira garraioaren erantzukizuna dutenak disoluzioan zehar; ioi positiboak eta negatiboak dira eroatea burutzen dutenak baina, gainera, beti aldaketa kimikoren bat gertatzen da elektrodoetan. Prozesuari elektrolisia esaten zaio.
Elektrolisia esplikatzea zaila izaten da askotan, baina errazen esplikatzen den elektrolisia –horregatik ikusiko da hemen– gatz fundituaren elektrolisia da. NaCl funditua ontzi batean jarrita eta bi elektrodo bertan, elektrolito upela eratu dela esango dugu. Korronte elektrikoa pasarazten denean, anodoan (anodo hitzak ez du zerikusirik polaritatearekin, nahiz kasu honetan positiboa izan) kloroa askatzen da, eta aldiz, katodoan (negatiboa) metalezko sodioa eratzen da, sodio kloruroaren gainean igeri. Anodoa, beti, oxidazioa gertatzen den elektrodoa da, eta katodoa erredukzioa gertatzen dena; oxidazio anodikoaz eta erredukzio katodikoaz hitz egiten da.
Esandako elektrolisian bi prozesu gertatu dira:
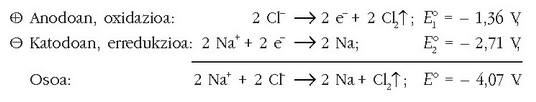
Erreakzioan NaCl funditua bi elementutan banatu da, sodioa eta kloro neutroa emanez. Erreakzio hau ez da berez gertatzen den erredox erreakzioa, bere potentzial negatiboak adierazten duen bezala, eta energia (elektrikoa kasu honetan) eman behar izan zaio gerta dadin.
Hain zuzen ere, berez gertatuta sortuko lukeen indar elektroeragilearen aurkakoa.
NaCl fundituaren elektrolisia eragiteko, gutxienez 4,07 V-ko potentziala ezarri behar da elektrodoen artean. Orduantxe gaindituko du energia elektrikoak energia kimikoa eta orduan gertatuko da kontrako erreakzioa berez.
Ur disoluzioaren elektrolisia ez da, eskuarki, horren erraza adierazten, baina ikus dezagun adibideren bat.
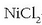 -zko disoluzioa baldin badugu
elektrolito upel batean, korronte elektrikoa pasarazten denean, gasa eratuko da anodoan, eta katodoa
metalezko geruza batez estaliko da.
-zko disoluzioa baldin badugu
elektrolito upel batean, korronte elektrikoa pasarazten denean, gasa eratuko da anodoan, eta katodoa
metalezko geruza batez estaliko da.
Korronte elektrikoak erredox erreakzio hau eragin du:
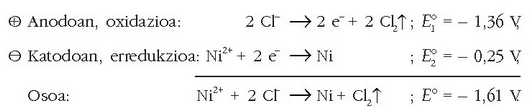
Aurreko adibidean bezalaxe anodoak (positiboa) anioiak (Cl - ) erakartzen ditu eta elektroiak eman (oxidatu);
katodoak (negatiboa), berriz, katioiak  erakartzen ditu eta elektroiak ematen dizkio (erreduzitu).
erakartzen ditu eta elektroiak ematen dizkio (erreduzitu).
Erreakzio osoa ez da berezkoa ( 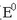 negatiboa da),
eta gertatuko bada, 1,61 V baino potentzial handiagoa duen indar elektroeragilea ezarri behar zaio.
negatiboa da),
eta gertatuko bada, 1,61 V baino potentzial handiagoa duen indar elektroeragilea ezarri behar zaio.
Elektrolisian, beraz, erredox erreakzio ez berezkoa sortarazten da korronte elektriko baten bitartez.
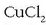 -zko ur disoluzioaren elektrolisian,
-zko ur disoluzioaren elektrolisian,
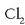 -a gas eran eta metalezko Cu-a eratzen dira.
Ezaguna den bezala, anodoan oxidazioa gertatuko da:
-a gas eran eta metalezko Cu-a eratzen dira.
Ezaguna den bezala, anodoan oxidazioa gertatuko da:
Anodoa: 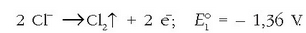
Ikusten den bezala elektrodo hau negatiboa da, elektroi iturri delako.
Katodoan, berriz, erredukzioa gertatzen da:
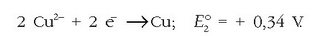
Elektrodo hau elektroi-hartzailea da eta positiboa da. Erreakzio osoa hauxe izango da:
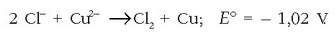
Erreakzioa ez da berezkoa eta 1,02 V-ko indar elektroeragilea beharko da erreakzioa idatzi den bezala gerta dadin
KOBRE SULFATOZKO DISOLUZIO BATEN ELEKTROLISIA
Irudiko ontzian kobre sulfatozko disoluzio bat dago, eta disoluzioan murgilduta grafitozko elektrodo bat. Ontzitik kanpo zilarrezko elektrodo zuria ikus daiteke. Bigarren irudian elektrodo biak disoluzioan sartuta ikusten dira. Hirugarrenean, berriz, zilarrezko elektrodoa disoluziotik kanpora dago, kobrez estalita (kolore gorrixka) elektrolisiaren ondorioz.

Faraday-ren legeak
Korronte elektriko bera pasatzen badugu zenbait disoluziotatik
( 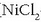 -zkoa,
-zkoa,
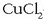 -zkoa eta
-zkoa eta
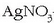 -zkoa) katodoan nikela,
kobrea edo zilarra hauspeatuko dira. Baina kantitate berdinak hauspeatuko ote dira hiruretan?
Edo, kantitate berdinak izango ote dira kobrearen eta nikelaren kasuan eta desberdina zilarrarenean,
bi lehenengoen karga aldaketa 2- izan delako eta hirugarrenarena 1-? Bikoitza ote zilar kantitatea beste biekiko?
Ala erdia? Ba ote dago erlaziorik disoluzioan barrena pasatutako korronte elektriko kantitatearen eta hauspeatutako gaiaren masaren artean?
-zkoa) katodoan nikela,
kobrea edo zilarra hauspeatuko dira. Baina kantitate berdinak hauspeatuko ote dira hiruretan?
Edo, kantitate berdinak izango ote dira kobrearen eta nikelaren kasuan eta desberdina zilarrarenean,
bi lehenengoen karga aldaketa 2- izan delako eta hirugarrenarena 1-? Bikoitza ote zilar kantitatea beste biekiko?
Ala erdia? Ba ote dago erlaziorik disoluzioan barrena pasatutako korronte elektriko kantitatearen eta hauspeatutako gaiaren masaren artean?
Halaxe da, erlazio zehatza dago elektrolito upelean barna pasatako elektrizitate kantitatearen eta hauspeatutako edo askatutako substantzia kantitatearen artean. Faraday-ren legeek ematen dute erlazio hori:
1.- Askatutako gaiaren masa, zuzenean, elektrizitate kantitatearen proportziozkoa da, hau da, korronte intentsitatearen eta denboraren proportziozkoa.
2.- Elektrizitate kantitate berdinaren eraginez askatutako zenbait gairen masak, gaien pisu baliokideen proportziozkoak dira, zuzenean.
Gai baten pisu baliokidea askatzeko behar den elektrizitate-kantitatea esperimentuz neurtu da eta 96.500 C-eko balioa du. Elektrizitate kantitate horri «faraday» esaten zaio, asmatu zuen ikertzailearen omenez eta F da unitatearen ikurra.
Hala, faraday bat pasarazten bada 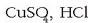 eta
eta
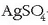 -zko disoluzioetatik, elektrodoetan askatutako
elementuen kantitateak ondorengoak izango dira:
-zko disoluzioetatik, elektrodoetan askatutako
elementuen kantitateak ondorengoak izango dira:
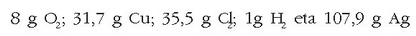
Hau da, gai bakoitzetik pisu baliokide bat.
Faraday baten balioa zenbakitan zein den jakinda, hona hemen laburbilduta Faraday-ren bi legeak:
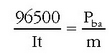
m askatutako edo hauspeatutako gaiaren masa da, 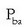 bere pisu baliokidea, I korronte elektrikoaren intentsitatea anperetan eta t korrontea pasatzen egon den denbora segundotan.
bere pisu baliokidea, I korronte elektrikoaren intentsitatea anperetan eta t korrontea pasatzen egon den denbora segundotan.
Faraday-ren legeak 1834.ean aurkitu ziren eta garrantzi handikoak izan dira kimika eta fisikaren ondorengo garapenerako. Elektrodo batean gai baten baliokidea askatzeko 1 mol elektroi behar da, hau da, faraday bat.
Beraz:
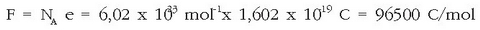
Faraday-ren legeak, batez ere elektrolisian erabili izan diren arren, pila batek sortutako korronteari ere aplika dakizkioke, mekanismoa, nahiz eta alderantzizkoa izan, berdin-berdina baita. Oro har, bada, gai baten baliokide-gramo bat oxidatzerakoan (edo erreduzitzerakoan), faraday bat sortzen (pilen kasuan) ala gastatzen da (elektrolisian).
157,2 pisu atomikoko metal kantitate bat HCl-tan disolbatu ondoren elektrolisia egin da. Upelean zehar 3.215 C-eko elektrizitatekantitatea pasa ondoren katodoan 1,74 g metal jalki dira. Metalaren ioiak zuen karga erraz kalkula daiteke Faraday-ren legeak erabiliz:
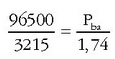
Metalaren pisu baliokidea, beraz:
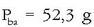
Bere pisu molekularra ezaguna denez, hauspeatze prozesuan elementuak jasan duen karga aldaketa hauxe izango da:
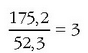
Hauspeatutako elementuaren karga 0 denez, ioiarena +3 izango da.
Pila lehorrak eta metagailuak
Galvaniren pilek –garrantzi teoriko handia izateaz gain– praktikan ere ikaragarria dute, batez ere intentsitate baxuko korronteak sortzeko. Hori dela eta tresna askotan erabili ohi dira: eskuargietan, magnetofonoetan, irrati hargailuetan, kalkulagailuetan, erloju elektrikoetan, e.a.; automobiletan ere erabiltzen dira motorea abian jartzeko.
Pila lehorra
Eskuargietan eta, erabili ohi den pila da eta 1,5 V-ko indar elektroeragilea sortzen du.
Polo positiboa (grafitozko ziria) eta negatiboa (zinkezko xafla zilindrikoa) ditu.
Biak batzeko solido zurgatzaile batean (zerrautsa edo asbestoa) zurgatutako
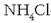 -zko ur nahastea erabiltzen da.
Grafitozko ziria
-zko ur nahastea erabiltzen da.
Grafitozko ziria 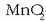 -z inguratua dago.
Hauexek dira gertatzen diren erreakzioak:
-z inguratua dago.
Hauexek dira gertatzen diren erreakzioak:
Polo negatiboan: 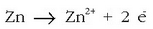
Polo positiboan: 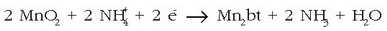
Polo positiboan gertatzen den erreakzioa ez da batere ezaguna eta pilak sortuko duen indar elektroeragilea
zein den, neurri handiagoan ala txikiagoan gertatuko da. Eratzen den ura pilak behar duen hezetasuna gordetzeko
egokia da eta  -ak, berriz,
-ak, berriz,
 -arekin erreakzionatuko du
-arekin erreakzionatuko du
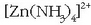 konplexua emateko. Horrela pila
puztuko lukeen amoniakoa galerazten da.
konplexua emateko. Horrela pila
puztuko lukeen amoniakoa galerazten da.
Dendetan saldu ohi diren pilak 4,5 V-koak izan ohi dira eta seriean jarritako hiru pila besterik ez dira
Metagailuak
Pila itzulgarriak dira: pila moduan funtzionatzen dutenean erreakzio bat ematen dute eta justu alderantzizkoa kontra doakion korronte elektrikoa ezartzen zaienean, orduan metagailua kargatu egiten delarik; hau da, hasieran zeuden erreaktiboak sortzen dira. Pila mota hauetan, beraz, ezingo dira gasak askatzen diren erreakzioak erabili, itzulgarritasuna galdu egingo litzatekeelako.
Gehien erabili ohi den metagailua berunezkoa da. Berunezko zenbait
xafla (polo negatiboa), berun dioxidozko xaflekin (polo positiboa) txandaka jarrita osatua dago, denak %20-ko portzentaia duen
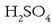 -zko ur disoluziotan murgilduta.
-zko ur disoluziotan murgilduta.
Hauexek dira gertatuko diren erreakzioak:
Negatiboan: 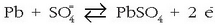
Positiboan: 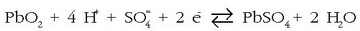
Deskarga prozesuan metalezko beruna 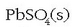 bihurtzen da (oxidatu), eta aldiz
bihurtzen da (oxidatu), eta aldiz 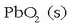 erreduzitu egiten da, gauza bera emanez.
Kargatzerakoan alderantziz gertatzen dira erreakzioak hasierako
erreaktiboak emanez.
erreduzitu egiten da, gauza bera emanez.
Kargatzerakoan alderantziz gertatzen dira erreakzioak hasierako
erreaktiboak emanez.
Metagailuak seriean konektatu ohi dira, bateria bat eratuz. Automobiletako bateriek sei elementu dituzte eta sor dezaketen indar elektroeragilea 12 V-koa izan ohi da. Automobilaren motorea geldi dagoenean bateriak sortzen du behar den korronte elektrikoa motorea abian jartzeko. Motorea abian dagoenean, ostera, automobilak ematen dio energia bateriari, alderantzizko erreakzioa gerta dadin eta karga dadin.
Michael Faraday
Michael Faraday (1791-1867) XIX. mendeko fisikari eta kimikari ospetsuenetako bat izan zen. Errementari baten semea zen, eta ez zuen oinarrizko hezkuntza besterik jaso. 14 urte zituela, liburu josle batekin hasi zen lanean, eta hori zela eta, liburu asko eta asko irakurtzeko aukera izan zuen, eta jakinmina piztu zitzaion. Lan orduz kanpo hainbat ikastarotan parte hartu zuen, eta zientzien inguruko jakinduria osatuz joan zen. 1812an, lagun batek sir Humphrey Davyren hitzaldi batzuetara joateko sarrerak eman zizkion. Han entzundakoa eta ikusitakoa baliatuz, liburuxka polit batzuk idatzi zituen, eta Davyrekin lanean hastea lortu zuen horri esker, Londresko Royal Institution delakoan. Institutuan sartu eta hilabete gutxira, Faradayk bi urteko bidaia egin zuen Italian eta Frantzian zehar, bere maisuaren laguntzaile gisa. Florentzian zeudela, Toscanako Dukeak zuen lente handi bat erabili zuten diamantea karbono hutsa zela frogatzeko. Diamantea eta oxigenoa zituen ontzi batera eguzki izpiak bideratu zituzten lentearen bidez, eta handik ordu betera erretzen hasi zen diamantea. Dena erre zenean, ontziaren barruan anhidrido karbonikoa eta, soberakin gisa, oxigenoa besterik ez zegoela egiaztatu zuten. Faradayren aurkikuntza nagusiak hauek dira: zenbait gas –anhidrido karbonikoa, hidrogeno sulfuroa, hidrogeno bromuroa eta kloroa, besteak beste– isurkari bihurtzea lortzea lehenengo aldiz; bentzenoa aurkitzea; 1831n indukzio elektromagnetikoa aurkitzea (aurkikuntza horri esker, lehenengo dinamoa egin zen handik 30 urtera). Gaur egungo industria elektrikoa Faradayren aurkikuntzen ondorio da neurri handi batean. Faradayk, indukzio gertaerak aztertzeaz gainera, korronte elektrikoak zituen eragin kimikoez arduratzen hasi zen 1834an. Ez zen bera horretan aritzen zen bakarra, baina bai, ordea, kalkulu matematiko zehatzak egin zituen lehena. Egiten zituen esperimentuen zehaztasunari esker, elektrolisiaren legeak lortu zituen. Faradayren helburu nagusia igarotako elektrizitate kantitatearen eta deskonposaturiko ur kantitatearen arteko proportzioa aurkitzea izan zen. Hala esan zuen Faradayk: elektrolisi esperimentu batean, proportzio zuzena dago disoluzioan zehar igarotako elektrizitate kantitatearen eta elektrodoetan itsatsitako sustantzia kantitatearen artean. 96.540 coulomb-eko karga igarotakoan ioiaren baliokide bat askatuko da. Faradayren esperimentuak zirela eta, «elektroi» deitu izan zenaren susmoa sortu zen lehen aldiz.
Nernst-en ekuazioa
Pila baten indar elektroeragile normala –baita elektrodo potentzial normala ere– pilaren indar elektroeragilea da, edota elektrodoaren potentziala, disoluzioan dauden ioien kontzentrazioak unitatea direnean. Kontzentrazioak unitatea ez direnean indar elektroeragileak edo elektro-potentzialak ez dira normalak deritzenak.
Daniell-en pilan gertatzen den erreakzioa hauxe da:
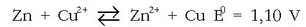
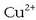 kontzentrazioa handitzen badugu edo
kontzentrazioa handitzen badugu edo
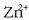 -arena txikitzen, edobiak batera,
erreakzioa eskuineko aldera abiatuko da, pilaren funtzionamendua areagotu eta indar elektroeragilea handituz.
Alderantziz gertatuko da
-arena txikitzen, edobiak batera,
erreakzioa eskuineko aldera abiatuko da, pilaren funtzionamendua areagotu eta indar elektroeragilea handituz.
Alderantziz gertatuko da 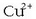 kontzentrazioa txikiagoa edo
kontzentrazioa txikiagoa edo
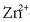 -arena handiagoa egiten badugu:
pilaren indar elektroeragilea txikiagotu egingo da.
-arena handiagoa egiten badugu:
pilaren indar elektroeragilea txikiagotu egingo da.
Pilaren indar elektroeragilea eta disoluziotan dauden ioien kontzentrazioak erlazionatzen dituen ekuazioa Nernst-en ekuazioa da. Daniell-en pilaren kasuan:
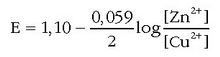
Eskuarki Nermst-en ekuazioa honelaxe idazen da:
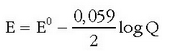
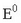 potentzial normala da, z erreakzioan
parte hartzen duten elektroien kopurua eta Q kontzentrazio-koefizientea deritzona. Hau zatikia bat da;
zenbakitzailean erreakzioko bigarren atalean dauden gai aktiboen kontzentrazioen (ber dagokien koefiziente estekiometrikoa)
biderkadura jarriko da eta izendatzailean ezkerreko atalean dauden gaien kontzentrazioak ber beren koefiziente estekiometrikoak.
potentzial normala da, z erreakzioan
parte hartzen duten elektroien kopurua eta Q kontzentrazio-koefizientea deritzona. Hau zatikia bat da;
zenbakitzailean erreakzioko bigarren atalean dauden gai aktiboen kontzentrazioen (ber dagokien koefiziente estekiometrikoa)
biderkadura jarriko da eta izendatzailean ezkerreko atalean dauden gaien kontzentrazioak ber beren koefiziente estekiometrikoak.
Nernst-en ekuazioa berdin-berdin erabil daiteke pilen kasuan nola elektrodoen kasuan;
lehenengoan 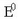 pilaren indar elektroeragileanormala
izango da eta bigarrenean elektrodoaren potentzial normala.
pilaren indar elektroeragileanormala
izango da eta bigarrenean elektrodoaren potentzial normala.
Pilan gertatzen ari den erreakzioa orekara iritsitakoan, ez du hortik aurrera energiarik emango, bere indar elektroeragilea zero izango da eta Nernst-en ekuazioa honelaxe geratuko da:
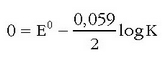
K orain erreakzioaren oreka-konstantea da. Erabilpen handikoa da ekuazio hau zenbait erreakzioren oreka-konstanteak esperimentuz neurtzeko.
Har dezagun ondoko erreakzioa:
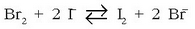
Erreakzioaren oreka-konstantea jakin nahi dugu. Badakizkigu jakin
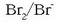 eta
eta
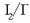 elektrodoen potentzial normalak:
+ 1,07 eta + 0,54 V.Erreakzio hori emango lukeen pilaren indar elektroeragile normala
kalkula daiteke:
elektrodoen potentzial normalak:
+ 1,07 eta + 0,54 V.Erreakzio hori emango lukeen pilaren indar elektroeragile normala
kalkula daiteke:
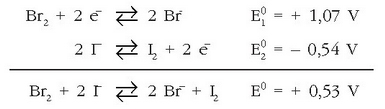
Nernst-en ekuazioa erabiliz:
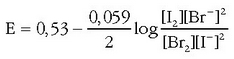
Orekan pilaren indar elektroeragilea zero denez:
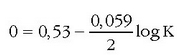
Beraz: