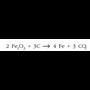Fisika-Kimika»Fisika - Kimika
Elektroi-transferentziazko erreakzioak
Oxidazioa eta erredukzioa
Oxidazio-erredukzio erreakzioak, gutxienez ere, azido-base erreakzioak bezain garrantzitsuak badira, ugariak direlako, alde batetik, eta asko erabiltzen direlako, bestetik; baina zertan dira antzekoak, galde daiteke, erredox erreakzioak eta azido-base erreakzioak?
Azido-base erreakzioak protoi-transferentziazko erreakzioak diren bezala, beste partikula baten transferentziaz gerta litezke erredukziooxidazio erreakzioak.
Ikuspegi klasikotik begiratuta oxidazioa substantzia bat oxigenoarekin konbinatzen denean gertatzen da eta erredukzioa alderantzizkoa izango litzateke, hau da, substantzia batek duen oxigenoa askatzen duenekoa. Hona bakoitzetik adibide bana:
oxidazioa: 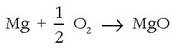
erredukzioa: 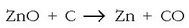
magnesioa oxidatu egin dela esango da eta zink oxidoa, berriz, erreduzitu. (prozesuan pisua galtzen duelako esaten da»erreduzitu» egin dela).
Azido-base kontzeptuaren antzera, hasieran zenbait erreakziotara mugatu bazen ere, poliki-poliki hedatzen eta zabaltzen joan zen, berehala ikusiko den bezala.
Hasteko, kasu batzuetan oxigenoa zenbait gairekin jartzen denean, substantzia hori oxidatzeko asmotan, oxidazioa emanez konbinatu ordez, beste erreakzio bat ematen du:
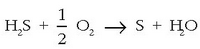
Oxidazio kontzeptua hedatu egin zen, beraz, eta oxidazioa hidrogeno galera
ere izan zitekeela esan zen; eta alderantziz, hidrogenoa hartzen zuen gai bat
erreduzitu egiten zela. Goiko adibidean oxigenoa erreduzitu egingo litzateke eta
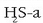 oxidatu.
Beste hau ere jar daiteke adibidetzat:
oxidatu.
Beste hau ere jar daiteke adibidetzat:
oxidazioa: 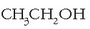 (etanola)
(etanola)
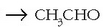 (formaldehidoa)
(formaldehidoa)
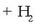
Erreduzkioa: 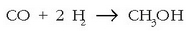 (metanola)
(metanola)
Oxigenoaren antzeko erreakzioak 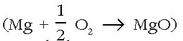 elementu ez-metaliko gehienek ematen zituztela konturatu ziren kimikariak geroago:
elementu ez-metaliko gehienek ematen zituztela konturatu ziren kimikariak geroago:
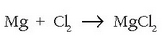
Atomoen elektroi egitura ezaguna zenez, eta lotura kimikoaren izaera ere bai, erreakzio biak kide-kidekoak zierela konturatu ziren:
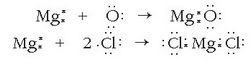
Kasu bietan magnesioak balentzia elektroiak (bi) galtzen ditu, bietan magnesio ioi bihurtuz. Nola bietan magnesioak aldakuntza berdina jasaten duen, behar-beharrezkoa ikusi zen oxidazio kontzeptua zabaltzea. Oxidazioa, horren ondorioz, elektroi-galera gertatzen den erreakzioa izango da eta erredukzioa elektroi-irabaztea gertatzen den prozesua.
Definizio horren arabera erraz irits daiteke ondorio honetara: erredukzioa ezin da bera bakarrik inoiz gertatu, ez bada oxidazio batekin batera; gai batek elektroiak irabazten baditu, beste batek galtzen dituelako da.
Horixe da hain zuzen, emandako adibideetan gertatzen dena. Bai oxigenoak eta bai kloroak magnesioak galdutako elektroiak hartzen dituzte eta anioi bihurtzen dira.
Oxidazio guztiak, beraz, erredukzioren batekin batera gertatzen dira. Horregatik erredukzio-oxidazioen erreakzioak deitzen zaie, erredox erreakzioak, labur esanda. Denetan elektroi transferentzia gertatzen da oxidatzen den gaitik erreduzitzen denera.
Zenbait kasutan zaila da esaten erreakzio bat erredox erreakzioa den ala ez, batez ere lotura kobalenteak tartean daudenean. Erreakzio honetan, adibidez:
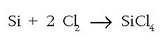
Nola 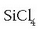
gaiaren loturak kobalenteak diren, ezin esan daiteke ez bata ez bestea ioi bihurtu direnik. Kloroa elektronegatiboagoa dela kontuan harturik, esan daiteke elektroi irabazte partziala izan duela. Eta silizioak elektroi galera partziala izan duela
Oxidazio-zenbakia
Konposatu kobalenteen erreakzioetan zaila da esaten zeinek irabazten dituen elektroiak eta zeinek galtzen, partzialki bada ere. Hau ebazteko oxidazio-zenbakia kontzeptua asmatu zen.
Konposatu bateko atomoak, bakoitzak bere oxidazio egoera du, atomo bakartuarekin erkatuz irabazi edo galdutako elektroi-kopuruaren arabera. Egoera hau ematen duen zenbakia da elementuaren oxidazio-zenbakia.
Oxidazio-zenbakia atomo batek konposatu batean duen elektroi kargari esaten zaio, baina ez dauka zertan erreala izanik.
Gai kimiko monoatomikoetan oxidazio-zenbakia karga erreala izango da.
Hala  eta
eta  aren kargak eta ondorioz, oxidazio-zenbakiak -2, -1, 0, +1 eta +2 izango dira.
aren kargak eta ondorioz, oxidazio-zenbakiak -2, -1, 0, +1 eta +2 izango dira.
Gai poliatomiko batean, ordea, oxidazio-zenbakia ez dago horren zehatz definituta eta ez da benetako karga elektrikoa.
Zein dira, adibidez,
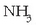 eta
eta
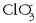 gaietan
atomoen oxidazio-zenbakiak? Kasu honetan oxidazio-zenbakia lortzeko zenbait arau jarri dira:
gaietan
atomoen oxidazio-zenbakiak? Kasu honetan oxidazio-zenbakia lortzeko zenbait arau jarri dira:
1) Aske dauden elementu guztien oxidazio-zenbakia zero da. Hau da
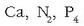 eta
eta
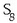 gaietan
denen oxidazio-zenbakia 2 4 8 zero da.
gaietan
denen oxidazio-zenbakia 2 4 8 zero da.
2) Hidrogenoaren oxidazio-zenbakia berau dagoen konposatuetan +1 da, hidruroetan izan ezik, hauetan -1 baita.
3) Oxigenoaren oxidazio-zenbakia, beronek parte hartzen duen konposatuetan -2 da, peroxidoetan izan ezik, hauetan -1 baita.
4) Metal alkalinoen oxidazio-zenbakia +1 da beti eta alkalino lurtarrena +2.
5) Halogenoen oxidazio-zenbakia -1 da haluroetan.
6) Molekula neutro bateko atomoen oxidazio-zenbakien batura zero da. Ioiena, berriz, bere kargaren balioa.
Arau hauekin erraz kalkula daiteke konposatu batean elementu batek duen oxidazio-zenbakia.
Honela bada, 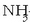 -an
edo
-an
edo 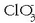 -an oxidazio-zenbakiak hauexek dira:
-an oxidazio-zenbakiak hauexek dira:
N = -3; H = +1; Cl = +5 eta O = -2, erraz atera daitekeen bezala:
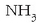 -an:
H = +1 da, 2. arauari jarraikiz.
-an:
H = +1 da, 2. arauari jarraikiz.
6. arauari jarraikiz: N + 3x(+1) = 0. Beraz: N = -3.
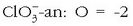 izango da,
3. arauari jarraikiz.
izango da,
3. arauari jarraikiz.
6. arauari jarraikiz: Cl + 3x(-2) = -1. Beraz: Cl = +5
Artifizial samarra bada ere oxidazio-zenbakia, oso erabilgarria da transferitutako elektroi-kopuruaren neurketa egiteko. Hala bada, silizioaren eta kloroaren arteko erreakzioan:
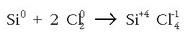
Denetan, elementu bakoitzaren gainean, dagokion oxidazio-zenbakia jarri da. Ikusten den bezala silizioaren oxidazio-zenbakia aldatu egin da 0-tik +4-ra, kloroarena 0-tik -1-era aldatu den bezala. Silizioa, beraz, oxidatu egin da eta kloroa erreduzitu.
Oxidazio-zenbakiaren bitartez orokortasun handiagoa eman dakieke erredox erreakzioei. Elementu bat oxidatu egingo da oxidaziozenbakia handiagoa egiten bada; erreduzitu, ostera, kontrako kasuan, hau da, oxidazio-zenbakia txikiagoa egiten denean.
Oxidazio-zenbakiak, esan beharra dago berriz ere, ez du ematen atomoaren karga elektriko erreala. NO-ren kasuan, adibidez, oxigenoaren oxidazio-zenbakia -2 da baina ez dago, egon, benetako -2 kargarik oxigeno atomoan. Ez eta +2 kargarik ere nitrogenoan.
NO-a konposatu kobalentea delako da hori horrela. CaO-ren kasuan, berriz, Ca-aren oxidazio-zenbakia eta benetako karga biak berdinak dira, +2 baliokoak, CaO-a konposatu ionikoa baita.<(p>
Kontzeptu desberdinak dira, bestalde, oxidazio-zenbakia eta balentzia. Karbonoaren zenbait konposatu idazten badira:
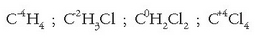
denetan karbonoaren balentzia laukoa da baina, ikusten den bezala, oxidazio-zenbakiak desberdinak dira. Zenbaitetan oxidaziozenbakia zatikia izan daiteke
Oxidatzaileak eta erreduzitzaileak. Erredox bikoteak
Magnesioa oxidatu egiten da, oxigenoaren edo kloroaren bitartez, bi erreakzio hauetan:

Baina esan ote daiteke magnesioak oxigenoa edo kloroa erreduzitu duenik?
Oxidatzailea, beste substantzia baten oxidazioa eragiten duen substantzia kimikoa da. Oxidatzen den gaiari erreduzitzailea esaten zaio, besterik gabe.
Oxidatzaileak, bada, beste konposatu oxidatzerakoan, elektroiak hartu behar ditu beste gaitik, hau da, erreduzitu egin behar da. Oxidatzailea, beraz, erreduzitu egiten da prozesuan.
Erreduzitzailearekin alderantziz gertatzen da. Beste substantzia bat erreduzitzen duenean, bera oxidatu egiten da, elektroiak galtzen dituelako.
Erredox erreakzioak, beraz, oxidazio-erredukzio bikoteka gertatzen dira, oxidazio-erredukzio pare konjugatu (edo erredox bikote) bidez:
Erreakzio honetan:
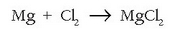
magnesioa erreduzitzailea da, oxidatu egiten delako prozesuan eta
 era oxidatua dagokio.
era oxidatua dagokio. 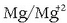 erredox bikotea da. Beste horrenbeste gertatzen da bestearekin;
erredox bikotea da. Beste horrenbeste gertatzen da bestearekin; 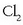 oxidatzailea da eta prozesuan erreduzitu egiten da,
oxidatzailea da eta prozesuan erreduzitu egiten da,
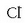 emanez;
emanez;
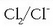 bikotea
erredox bikotea da.
bikotea
erredox bikotea da.
Oxidatzailea ala erreduzitzailea izatea erlatiboa da, azido eta baseen kasuan bezala.
Hidrogeno peroxidoa 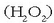 ,
adibidez, oxidatzailea da eskuarki baina erreduzitzailea ere izan daiteke, potasio permanganatoarekin
,
adibidez, oxidatzailea da eskuarki baina erreduzitzailea ere izan daiteke, potasio permanganatoarekin
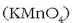 erreakzionatzen duenean, adibidez.
erreakzionatzen duenean, adibidez.
Erredox bikoteen indar erlatiboen eskala antola daiteke ezagunak diren bikote guztiekin. Erraz ulertzen da ondorengoa: erreduzitzaile sendo bati –elektroiak emateko erraztasun handia duan bati, alegia– dagokion oxidatzaileak joera txikia (oxidatzaile konjugatu ahula) izango du elektroiak irabazteko. Alderantzizkoa ere egia da: oxidatzaile sendo bati erreduzitzaile ahula egokituko zaio.
Erredox erreakzioen doiketa
Erredox erreakzioen doiketa zaila izan ohi da kasu askotan, ohiko metodoak erabilita.
Erredox ekuazioa formulatzeko beharrezkoa da, lehenbizi, erreakzioan parte hartzen duten substantziak zeintzuk diren ondo jakitea, bai produktuak eta bai erreaktiboak. Azken hauek, kasu errazetan izan ezik, ezin daitezke iragarri segurtasun osoz eta sarritan desberdinak izaten dira, erreakzioa segun eta zer egoeratan burutzen den.
Behin erredox bikoteak zein diren zehatz jakin eta gero erreakzioaren formulazioa eta doiketa bi metodoren bidez egin daiteke.
Argazkigintza
Zuri-beltzeko argazki filma zilar haluro baten (normalean zilar kloruroa, AgCl) kristaltxoez osaturik dago. Kristaltxo horiek gelatina batean (argazki emultsioa) suspentsioan daude eta zelulosa azetatozko plastiko bat estaltzen dute. Filma argitan jartzen denean, kristaltxo horietako zilar katioiak deskonposatu egiten dira, zilarrezko atomoak sortuz (Ag). Fotosentikortzea esaten zaio prozesu horri. Fotosentikorturiko kristaltxoak lehenago erreduzitzen dira zilar metalikora, fotosentikortu gabe daudenak baino. Hori horrela zergatik gertatzen den oso ongi ulertzen ez bada ere, garrantzi handikoa da hala izatea argazkiak lortzeko prozesuan.
Fotosentikorturiko kristaltxoak erreduzitzeari argazkia errebelatzea esaten zaio, eta gai erreduzitzaileari errebelatzaile. Errebelatzaileak gai erreduzitzaie organikoak dira; gelatinan sartuta, oso azkar erreduzitzen dituzte sentikorturiko kristaltxoak, baina besteen erredukzioa, aldiz, oso mantso gertatzen da. Errebelatzaileen artean, 1,4-dihidroxibentzenoa (hidrokinona) da erabilienetako bat. Prozesu honetan erreduzitzailea oxidatu egiten da eta kinona ematen du:
Filman sentikorturiko zilar
katioiak Ag emateko erreduzituko dira. Horrela filman zilar metalikoaren kantitatea
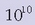 aldiz handiagoa egingo da. Jasotako irudiaren intentsitatea, beraz,
aldiz handiagoa egingo da. Jasotako irudiaren intentsitatea, beraz,
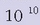 aldiz handiagoa egingo da. Gero, sentikortu gabeko zilar
haluroaren kristaltxoak sodio tiosulfatozko disoluzio batean disolbatuko
dira. Bestela, kristaltxo horiek ere erreduzitu egingo
lirateke, eta, azkenean, film osoa belztuko litzateke.
aldiz handiagoa egingo da. Gero, sentikortu gabeko zilar
haluroaren kristaltxoak sodio tiosulfatozko disoluzio batean disolbatuko
dira. Bestela, kristaltxo horiek ere erreduzitu egingo
lirateke, eta, azkenean, film osoa belztuko litzateke.
Filma poliki garbitu ondoren, zilar metalikoa besterik ez da gelditzen gainean. Zilar metaliko hori trinkoagoa izango da (ilunagoa, beraz) argitan denbora gehiago egon diren zatietan, eta arinagoa, berriz, (argiagoa, beraz) besteetan. Egoera horretan dagoenean, filmari negatibo esaten zaio. Eta argia, negatiboan zehar, argazki paperaren gainean (hots, argazki emultsioz estaliriko paperean) proiektatuz gero, irudi positiboa lortuko da.
Oxidazio-zenbakiaren metodoa
Oxidatzen diren atomoen oxidazio-zenbakien gehikuntzaren batura eta erreduzitzen diren atomoenena berdinak dira. Lege hori da metodo honetan oinarritzat hartzen dena.
Adibidetzat, doitu gabeko erredox erreakzio hau jarriko da:
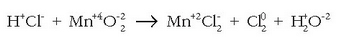
Atomo guztien gainean beren oxidazio-zenbakiak jarri dira, argi ikusteko zein diren oxidatzen direnak eta zein erreduzitzen direnak. Kloroa oxidatu egiten den bitartean manganesoa erreduzitu egiten da eta prozesuak honelaxe idatz daitezke:
Oxidazio-zenbakia handiagoa egin da: 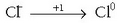
Oxidazio-zenbakia txikiagoa egin da: 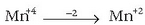
Oxidazio-zenbakien aldaketek berdinak izan behar dutenez:
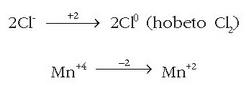
Hauxe idatz daiteke, beraz:
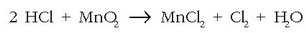
Egindako eragiketaren bidez oxidatzen diren eta erreduzitzen diren atomoak doitu dira, baina badaude zenbait atomo –horien ar - tean kloro atomo batzuk–, erredox prozesurik jasan ez dutenak. Erreakzioaren eskuineko aldean dauden 4 kloroetatik bi oxidazioz sortu dira baina beste biek ez dute aldaketarik izan. Beraz:
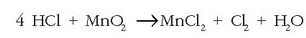
Bigarren adibide honetan laburrago egingo da doiketa:
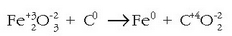

Erreakzioa doituta horrela izango da:
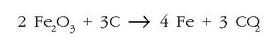
Ioi-elektroi metodoa
Erredox erreakzioak eskuarki ioi artean gertatzen diren erreakzioak dira. Galvaniren pilen funtzionamenduak adierazten duen bezala, oxidazio-erredukzio erreakzio bat bi erdi erreakziotan –bata oxidaziozkoa eta erreduziozkoa bestea– bana badaiteke, honek ioielektroiaren metodoaren oinarria ematen du.
Ioi-elektroiaren metodoan –zentzuzkoagoa, ez aurrekoa bezain artifiziosoa– erreakzio osoa bi erreakziotan banatzen da; hauetan ioiek eta elektroiek hartzen dute parte baina gai batek askatzen dituen elektroiak besteak hartuko ditu.
Adibidetzat, zinkaren eta azido nitrikoaren arteko erreakzioa jarriko dugu. Emaitzak zink ioia eta amonio ioia dira.
Ezer baino lehen erdi erreakzioak idatziko dira:
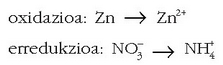
Lehenengo urratsetan, elektroien doiketari ekin baino lehen, atomoak eta kargak doitzen dira. Atomoak doitzeko oxigenoarekin hasiko gara –horrelako atomorik badago behintzat–, eta behar den erreakzioaren aldean behar hainbeste H2O molekula jarriko dira, horrela:
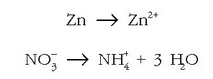
Ondoren, hidrogeno atomoak doituko dira behar den aldean protoiak
 jarriz:
jarriz:
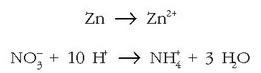
Orain da kargak doitzeko unea, elektroien 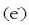 bitartez:
bitartez:
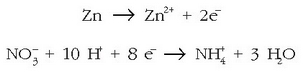
Lehenengo erdi erreakzioan karga zero da ezker aldean; eskuineko aldean ere zero izan dadin 2 elektroi jarriko dira.
Bigarren erdi erreakzioan karga positibo bat dago eskuineko aldean eta bederatzi karga positibo ezkerrekoan. Ezkerreko aldean zortzi elektroi jarrita, erreakzioaren alde bietan karga berdina izango dugu, +1.
Bigarren erdi erreakzioan zortzi elektroi daude jokoan, eta lehenengo erreakziotik sortu beharko dute prozesu osoa gertatu ahal izan dadin. Elektroi kopurua berdintzeko erdi erreakzio bietan lehenengoa 4z biderkatuko dugu, ondoren erreakzio bien batuketa egiteko:
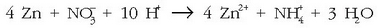
Horra erredox ekuazio ionikoa. Duen abantaila bat hauxe da: erreakzioak edozein nitratorentzat
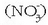 balio du,
azido nitrikoa izan edo beste edozein nitrato izan. Nitratoa oxidatzailea dela esango dugu. Erreakzioa gertatuko bada,
ikusten den bezala, H+-ak behar dira, hau da, azido sendoren bat behar da, hamar protoi eman ditzan.
balio du,
azido nitrikoa izan edo beste edozein nitrato izan. Nitratoa oxidatzailea dela esango dugu. Erreakzioa gertatuko bada,
ikusten den bezala, H+-ak behar dira, hau da, azido sendoren bat behar da, hamar protoi eman ditzan.
Eman dezagun erredox erreakzio hori zinkaren eta potasio nitratoaren
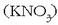 artean gertatzen dela, azidoa azido sulfurikoa
artean gertatzen dela, azidoa azido sulfurikoa 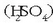 izanik. Erreakzio molekularra ondorengoa izango da:
izanik. Erreakzio molekularra ondorengoa izango da:
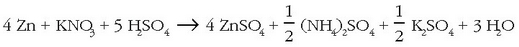
Metodo biak adibide berarekin aldera daitezke.
Erreakzioa HI-aren oxidazioa izango da 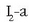 emateko,
potasio dikromatoaren bitartez
emateko,
potasio dikromatoaren bitartez 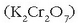 eta ingurune azidotan:
eta ingurune azidotan:
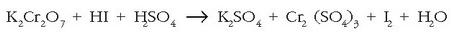
a) Oxidazio-zenbakiaren metodoa labur-labur:
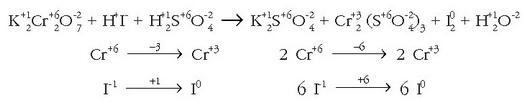
Honekin oxidatu eta erreduzitzen diren atomoak doitu daitezke:
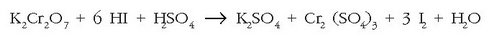
Bukatzeko beste guztiak doituko dira:
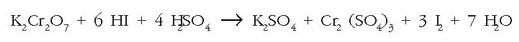
b) Ioi-elektroiaren metodoarekin erraztasun handia lortzen da, ikusiko den bezala:
Oxidazioa: 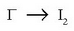
Erredukzioa: 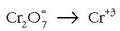
Atomoak berdinduz:
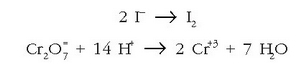
kargak doituz:
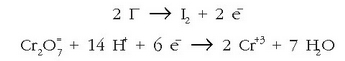
Lehenengoa hiruz biderkatuz eta batuz:
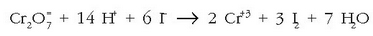
14 protoi behar dira ezker aldean,
baina nola 6 jarri dir en HI-ajartzerakoan, nahikoa da lau molekula
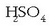 jartzearekin.
Emaitzak doitzea begibistakoa da:
jartzearekin.
Emaitzak doitzea begibistakoa da:
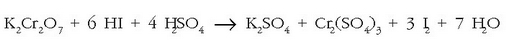
ZINKAK KOBRE SULFATOZKO DISOLUZIOAREKIN EMATEN DUEN ERREAKZIOA
Lehenengo irudian kobre sulfatozko disoluzio urdina ikus daiteke; eta ontzitik kanpo zinkezko xafla bat, zuri distiratsua. Bigarren irudian zinka disoluzioan sartuta ikusten da; disoluzioan sartuta dagoen zinkezko xaflaren partea ilunduta dago. Hirugarren irudian xafla disoluziotik atera da; metala kobrezko geruza gorrixka batek estalita gelditu da.