Fisika-Kimika»Fisika - Kimika
Energia erreakzio kimikoetan
Energia aldaketa erreakzio kimikoetan
Gizarteak betidanik erabili izan ditu erreakzio kimikoak energia lortzeko. Energia esaten denean beroa, argia, elektrizitatea, etab. esan nahi da. Hasieran egurraren edo ikatzaren errekuntza erreakzioak erabili ziren energia lortzeko, gaur egun espazio ontzietan eta hegazkinetan gertatzen diren erreakzioak erabiltzen dira*. Erreakzio kimikoekin batera, bada, energia askatzen da batzuetan; beste batzuetan, ostera, energia absorbatu edo xurgatu egiten da. Era batera zein bestera, erreakzio kimikoekin batera energia trukea gertatzen da beti.
Zenbat energia sor dezake erreakzio kimiko batek? Nondik dator energia hori? Nola neur daiteke?
Erreakzio kimiko baten produktuen energia edukina eta erreaktiboena ez dira berdinak izaten. Ezberdintasun hori da, hain zuzen, erreakzio kimikoan jokoan dagoena.
Molekula bakoitzak energia kimiko jakin bat du, barne energia deritzona, atomoen arteko loturak zein eta nolakoak diren. Erreakzio kimiko batean energia askatzen bada, barne energia txikiagotu delako gertatzen da hori; alderantziz, barne energia handitzen denean energia xurgatzen da.
Erreakzio batean era askotako energia aska edo xurga daiteke –argia, energia elektrikoa,
mekanikoa, etab.–, baina gehienetan bero erakoa izan ohi da.
Erreakzio kimiko batean xurgatutako edo askatutako beroari erreakzio beroa esaten zaio eta,
edozein baldintzatan eman badaiteke ere, oro har 25°C-tan eta 1 atm-ko presioan askatu ohi da.
Bestalde, erreakzio kimikoak endotermikoak ala exotermikoak izan daitezke, beroa xurgatu ala
askatzen den kontuan harturik. Adibidez 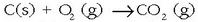 erreakzioa exotermikoa da, beroa askatzen delako -393.5 kJ zehazki-, eta honela adierazten da:
erreakzioa exotermikoa da, beroa askatzen delako -393.5 kJ zehazki-, eta honela adierazten da:
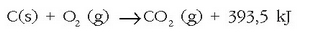
Aldiz,
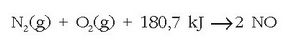
erreakzioa endotermikoa da.
Horrela adierazten diren ekuazio kimikoei ekuazio termokimiko deritze, eta erreakzioan parte hartzen duten gaien kantitateak, beren agregazio egoerak (parentesi artean) eta erreakzioan adierazten den materia kantitatearentzat xurgatu ala askatutako beroa ematen dituzte aditzera. Bero kantitatea ezkerreko aldean azaltzen bada, erreakzioan xurgatutako bero kantitatea adierazten du. Eskuineko aldean azaltzen bada, ostera, askatutako beroa adieraziko du.
Erreakzio kimiko batean xurgatutako ala askatutako bero kantitatea erreakzioan parte hartzen duten materien kantitatearen zuzenki proportzionala da. Zenbat eta materia kantitate handiagoak parte hartu erreakzioan, orduan eta bero gehiago xurgatu ala askatuko da.
Energiaren kontserbazioa erreakzio kimikoetan
Zenbait erreakziotan (errekuntza erreakzioetan batez ere) energia asko sortzen da. Sortutako energiaren parte batekin erreakzioko produktuak berriro erreaktibo bihurtzea lortuko balitz, orduan mugagabeko energia sortzaile bat edukiko genuke; erreaktiboekin erreakzioa sortaraziko genuke, aldiko energia gehiago eta gehiago sortuz. Baina egin al liteke hau? Erantzuna ezezkoa da.
Iragan mendearen erdialdean egindako esperimentuei esker energiaren kontserbazioaren printzipioa asmatu zuten zientzialariek; printzipio horren arabera, energia ez da ez sortzen ez desagertzen, eraldatu besterik ez da egiten. Energiaren kontserbazioaren legea erreakzio kimiko guztietan betetzen da.

Uraren deskonposatze elektrolitikoa nola egin daitekeen adierazten du irudiak. Energia elektrikoa xahutu ahala, oxigenoa eta hidrogenoa askatzen dira.
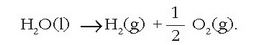
Uraren deskonposatze horretan erabilitako energia elektrikoaren kantitatea formula honen bidez kalkula daiteke: E = IVt, zirkuituan zehar igarotzen den korrontearen intentsitatea (I), eta tentsioa (V), erraz neur baitaitezke. Denboraren aldagaiak (t) esperimentua burutzeko behar den denbora adierazten du eta, beraz, aldagai ezaguna da. Esperimentua egiteko denboran zenbat oxigeno deskonposatu den jakiteko, pisatu egiten da. Beraz ur kantitate jakin bat deskonposatzeko behar den energia kantitatea ezaguna da.
Beste esperimentu batean alderantzizko erreakzioa egin daiteke, hau da, uraren sintesia bere elementuetatik abiatuta:
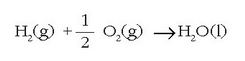
Esperimentu hau bonba kalorimetrikoa deritzon tresna batean egiten da. Oxigenoa eta hidrogenoa kantitate jakinetan jarri eta erreakzioa eragiten da. Prozesu horretan beroa askatzen da, eta termometro baten tenperatura aldaketaren bidez neur daiteke bero kantitate hori.
Lehenengo saiakeran behar izandako energia elektrikoa eta honetan askatutako beroa, bietan ur kantitate berdina erabili bada, berdin- berdinak izango dira.
Erreakzio entalpia
Eman dezagun 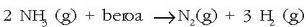 erreakzioa hartzen dugula. Erreakzio hori era askotara bidera daiteke: bainu termostatiko batean sartuta
tenperatura konstantean, bolumena ezin alda dakiokeen ontzi batean, presio konstantean, etab.
Baina, erreakzio beroa berdina ote da kasu guztietan? Ezezkoa da erantzuna, baldintzen arabera
aldatu egiten delako erreakzio beroa, ez baita egoera aldagai bat. Bi kasu alderatu dira hori frogatzeko:
bolumen konstantean (ikus a) irudia) gertaturiko erreakzio bat, eta presio konstantean gertaturikoa bestea (ikus b) irudia.
erreakzioa hartzen dugula. Erreakzio hori era askotara bidera daiteke: bainu termostatiko batean sartuta
tenperatura konstantean, bolumena ezin alda dakiokeen ontzi batean, presio konstantean, etab.
Baina, erreakzio beroa berdina ote da kasu guztietan? Ezezkoa da erantzuna, baldintzen arabera
aldatu egiten delako erreakzio beroa, ez baita egoera aldagai bat. Bi kasu alderatu dira hori frogatzeko:
bolumen konstantean (ikus a) irudia) gertaturiko erreakzio bat, eta presio konstantean gertaturikoa bestea (ikus b) irudia.
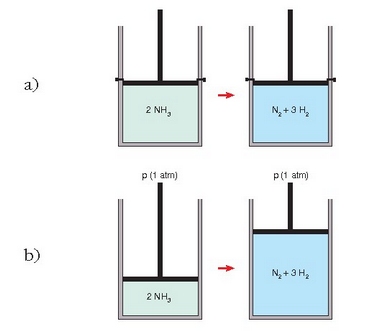
a) Erreakzioa bolumen konstantean gertatzen da, esperimentua egitean sistemari bolumena aldatzea eragozten zaiolako. Oro har, presioa aldatu egingo da erreakzioan zehar.
b) Sistemari ez zaio oztoporik jarri bolumenari dagokionez, eta horrenbestez, bolumena aldakorra izango da. Presioa izango da aldatuko ez den ezaugarria. Erreakzioa presio konstantean gertatuko da hortaz, kanpoko presioan.
Lehenengo kasuan xurgatutako beroari erreakzio beroa bolumen konstantean esaten zaio eta, termodinamikaren arabera, sistemaren baitan gertaturiko barne energiaren aldaketa da:
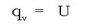
Bigarrenean xurgatutakoari erreakzio beroa presio konstantean esaten zaio eta, termodinamikako azalpenei jarraituz, entalpia aldaketa adierazten du:
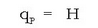
Lehenengoaren balioa 87,3 kJ-koa da, eta bigarrenarena 92,2 kJkoa. Zergatik dira desberdinak bataren eta bestearen balioak? Energiaren iraunkortasunaren printzipioa urratzen al dute esperimentu horien ondorioek?
Ez; are gehiago, berretsi egiten da energiaren iraunkortasunaren legea.
Bolumen konstantean eta presio konstantean xurgatutakobero kantitateak berdinak dira izatez,
baina presio konstantean gertatutakoari zabaltze lana erantsi behar zaio; horregatik presio
konstantean xurgatutako beroa handiagoa da bolumen konstantean xurgatutakoa baino:
 Bolumen aldaketarik ez dagoen erreakzioetan eta horietan bakarrik, berdintza hau beteko da:
Bolumen aldaketarik ez dagoen erreakzioetan eta horietan bakarrik, berdintza hau beteko da:
H = U.
Erreakzio kimiko gehienak bai laboratorioan eta bai industrian presio konstantepean egiten direnez, erreakzio beroaz hitz egin beharrean erreakzio entalpiaz hitz egiten da, eta honela adierazten da erreaktiboen eta produktuen entalpien funtzioan:
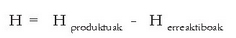
Produktuen entalpien batura erreaktiboen batura baino handiagoa bada H > 0 izango da eta erreakzio endotermiko bat izango da. Erreakzioan beroa xurgatuko da entalpia handiagoa izan dadin. Aldiz, produktuen entalpien batura erreaktiboen batura baino txikiagoa bada, erreakzioa exotermikoa izango da: H < 0. Erreakzioan soberan dagoen beroa askatu egingo da. Irudian ikus daitezke bi prozesuak.
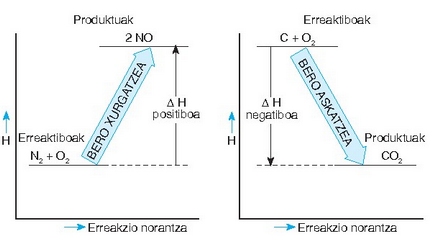
Presio konstanteko erreakzioetan entalpiak ematen du erreakzioa endotermikoa ala exotermikoa den
Ondoren ematen den erreakzio termokimikoa 25°C-tan eta 1 atm-ko presioan gertatutakoa da:

Erreakzio hau endotermikoa da, eta beroa behar du gertatuko bada. Jakin nahi da 60,6 g merkurio (II) oxido deskonposatzeko sistemak xurgatu beharko duen bero kantitatea zenbatekoa den.
Ekuazio termokimikoak nahikoa informazio ematen du hori kalkulatu ahal izateko: 2 mol HgO deskonposatzeko sistemak 181,6 kJ xurgatu ditu. HgO-aren pisu molekularra 216,6 g/molekoa izanik, 216,2 x 2 = 433,2 g HgO dira deskonposatzen direnak emandako bero kantitatea xurgatutakoan.
60,6 g deskonposatzeko xurgatu beharko duen bero kantitatea hau da:

Ekuazio termokimiko batek ematen duen informazioa ez da hor amaitzen: 2 mol HgO (edo beste era batera adierazita, 2 x 216,6 = 433,2 g HgO) deskonposatzeko, erreakzioaren arabera, 181,6 kJ behar dira. Zenbat HgO deskonposa daiteke 100 kJ energiarekin?
Emaitza:
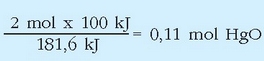
Edo gramotan:

Josiah Willard Gibbs
Yaleko unibertsitateko irakasle baten semea zen. Gibbs izan zen Estatu Batuetako unibertsitate batean zientzia doktoretza lortu zuen lehena. Frantzian eta Alemanian ikasketak egin ondoren, New Havenera itzuli zen 1869an. 1871ean Fisika teorikoaren irakasle izendatu zuten, eta lanbide horretan iraun zuen hil zen arte. Gibbs Estatu Batuetan jaiotako zientzialari bikainenetako bat izan zen, askoren ustean. Gizon xaloa eta bere baitara bildua zen, eta irakasle txarra zela ere egotzi zioten batzuek. Oso gutxi bidaiatu zuen, eta ez zuen ia harremanik izan garai hartako Europako zientzialari handiekin. Bere kasa ari izan zen lanean, termodinamikaren printzipioak erreakzio kimikoetara aplikatu zituen oso modu arduratsuan eta matematikaz zehatz baliatuz. Bere lanak Transactions of the Connecticut Academy of Sciences aldizkarian argitaratu zituen 1876tik 1878ra bitartean. Zoritxarrez, aldizkari hori ia ez zen ezagutzen Europan, eta Gibbsek hain modu labur eta abstraktuan idazten zuen, non zientzialari gehienek nekez ulertzen ahal zituzten haren idazlanak. Einsteinek berak hauxe esan zuen Gibbsek gerora idatzitako liburu batez: «Maisu lan bat da, baina oso zaila da irakurtzeko». Europako kimikariek eta fisikariek ez zuten 1890 arte izan Gibbsen lanaren berri. Orduz geroztik, mundu osoan aitortu zitzaion termodinamikari egin zion ekarri ezinago garrantzitsua, eta gaur egun haren lana termodinamika kimiko modernoaren oinarrietako bat da oraindik.
Hess-en legea
Erreakzio kimiko baten beroa neurtzea lan neketsua da eta denbora asko hartzen duena gainera. Garrantzi handiko erreakzio kimiko asko dago eta interesgarria denez denen erreakzio beroa zenbatekoa den jakitea, bideren bat aurkitu behar da neurri esperimentalak egiteko beharrik gabe bero horren balioak kalkulatzeko. Izan ere, erreakzio guztien entalpia aldaketak neurtzeko sistemarik aurkitu ezean, urteak eta urteak beharko lirateke saio guztiak egiteko.
Entalpia egoera funtzioa da eta, horren ondorioz, bere balioa hasierako eta bukaerako egoeren mende dago bakarrik. Beste horrenbeste erreakzio kimikotan, erreakzio entalpia hasierako eta bukaerako produktuen entalpien funtzioa izango da eta ez da aldatuko tartean beste erreakziorik gertatu arren. Honek aukera ematen du esperimentu bidez ezin neur daitezkeen entalpiak kalkulatzeko.
Har dezagun, adibidez, karbono monoxidoa ematen duen karbonoaren (grafitoa) errekuntza erreakzioa:
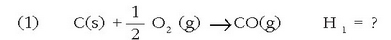
Interes handikoa da baina ezin da zuzenean neurtu kalorimetro batean, oxigeno asko behar denez,
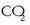 ere eratzen delako.
Hori dela eta ezinezkoa da erreakzioaren entalpia aldaketa neurtzea. Hala ere, erraz neur daiteke CO-aren errekuntza entalpia:
ere eratzen delako.
Hori dela eta ezinezkoa da erreakzioaren entalpia aldaketa neurtzea. Hala ere, erraz neur daiteke CO-aren errekuntza entalpia:
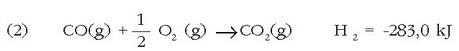
Anhidrido karbonikoa ematen duen karbonoaren (grafitoa) errekuntza entalpia ere esperimentu bidez beha daiteke:

Bistan da (3) erreakzioa beste bien ondorioa dela, eta bata bestearen ondoren gertatzen direla, hau da (3) = (1) + (2) dela. Entalpia aldaketentzat ere antzera gertatzen da, irudian ikusten den bezala:
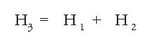
Entalpia aldaketen balioak ordezkatuz:
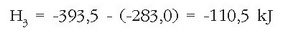
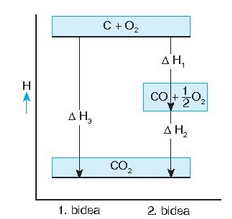
Erreakzio entalpien gehigarritasuna ageri duen diagrama
Emandako adibidea Hess-en legearen adibide sinple eta erraza da, eta honela adieraz daiteke: erreakzio kimiko bat beste zenbait erreakzioren batura aljebraikoa bada, erreakzio entalpiak ere batura aljebraiko bera beteko du.
Hess-en legea oso baliagarria da, aukera ematen baitu erreakzio askoren entalpia aldaketa kalkulatzeko. Izan ere, sarritan erreakzio horiek burutu ere ezin dira egin esperimentalki.
Metanoaren eraketa entalpia lortu nahi izanez gero, dagokion erreakzioa gertarazi beharko litzateke lehenik laboratorioan:
Hau ezinezkoa da ordea, eta beste erreakzio batzuek baliatu behar dira hori lortzeko:
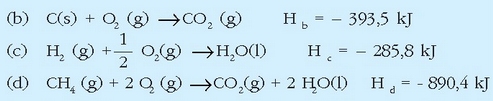
Lau ekuazio termokimiko horien artean erlazio matematiko haubetetzen da:
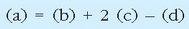
Eta erreakzio entalpiek ere erlazio bera beteko dutenez:
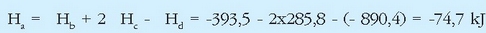
Hori da, beraz, metanoaren eraketa entalpiaren balioa.
Eraketa entalpia
Milaka erreakzio kimiko daude erreakzio entalpia ezaguna dutenak. Entalpien balioak tauletan jartzea eta ordenatzea lan neketsua da ordea, eta zailagoa oraindik liburuetan jartzea, hartuko lukeen neurriagatik. Zer bide har daiteke, datu guztiak jarri gabe, horiek denak kontuan hartzeko edo, behinik behin, kalkulatu ahal izateko?
Hori lortzeko modurik egokienetako bat eraketa entalpia normalak taula batean agertzea da. Substantzia baten eraketa entalpia substantzia horren mol bat, egoera normalean, eratzean gertatzen den entalpia aldaketa da, elementuak ere denak beren egoera normaletan direla. Egoera normalaren ezaugarriak 1 atm-ko presioa eta 25°C-ko tenperatura (298 K) dira.
Ondoren azaltzen den erreakzioa amoniakoaren eraketa erreakzioari dagokio:

eta erreakzio horri dagokion entalpia aldaketa amoniakoaren eraketa entalpia izango da. Erreaktiboak biak gas egoeran adierazi dira, gasak direlako izan ere, egoera normaletan.
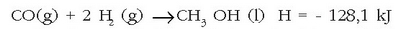 erreakzioa ez da
metanolaren eraketa erreakzioa; dagokion entalpia aldaketa ere ez da izango metanolaren eraketa entalpia.
Zuzen idazteko honelaxe idatzi behar litzateke:
erreakzioa ez da
metanolaren eraketa erreakzioa; dagokion entalpia aldaketa ere ez da izango metanolaren eraketa entalpia.
Zuzen idazteko honelaxe idatzi behar litzateke:
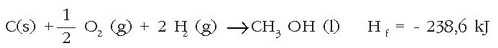
Definiziotik beretik abiatuta, egoera normalean dagoen edozein elementuren eraketa entalpia zero dela ondoriozta daiteke:

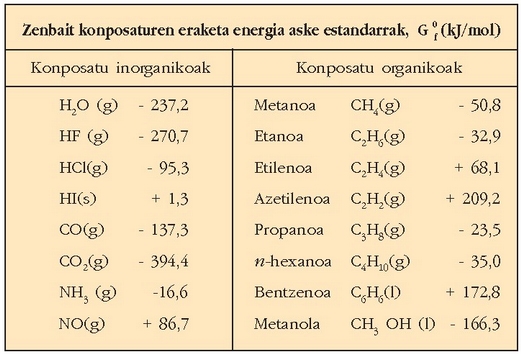
Taula honetan zenbait gaik 25°C-tan 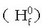 dituzten eraketa entalpiak ematen dira.
dituzten eraketa entalpiak ematen dira.
Zenbait konposatuen eraketa entalpiak, H0f , 250 C-tan, kJ/mol:
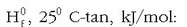
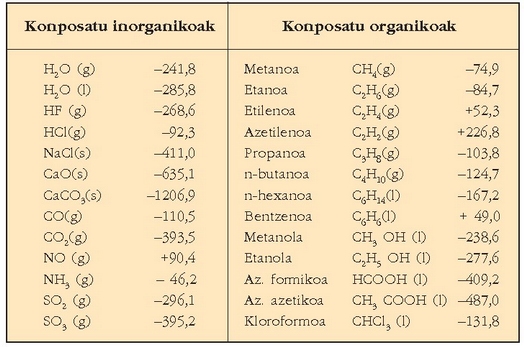
Hess-en legea erabiliz, eraketa entalpietatik edozein erreakzio kimikoren erreakzio entalpia kalkula daiteke; aski da erreakzioan parte hartzen duten gaien eraketa entalpia zein den jakitea, eta entalpia horiek tauletan eman ohi dira.
Azido nitrikoa industrian egiteko prozesuan urrats asko ematen dira, baina horietako bat amoniakoaren oxidazio katalitikoa da:
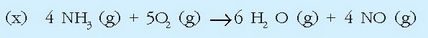
Dagokion erreakzio entalpia lortzea erraza da, erreakzioan parte hartzen duten gaien eraketa entalpiak ezagunak badira. Taulan daude behar diren datu guztiak:
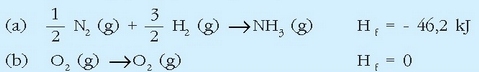
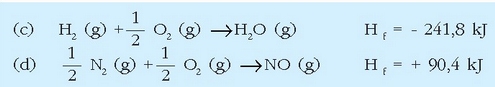
Erreakzio termokimiko horiek (x) = 6(c) + 4(d) - 4 (a) erlazioa betetzen dutenez, Hess-en legea erabiliz:
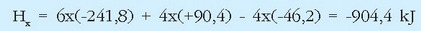
Lotura energiak
Erreakzio kimiko batean zenbait lotura hausten eta lotura berriak eratzen dira; erreakzio kimiko guztiak horrela defini daitezke. Lotura horien energia, bai hausten direnena bai eratzen diren lotura berriena, ezaguna balitz, erreakzioen entalpiak aurkitzeko aukera legoke.
Lotura energia mol bat lotura, hau da  lotura,
apurtzeko behar den energia da. Hala, adibidez, hidrogeno/kloro loturaren energia erreakzio honi dagokion energia izango litzateke:
lotura,
apurtzeko behar den energia da. Hala, adibidez, hidrogeno/kloro loturaren energia erreakzio honi dagokion energia izango litzateke:
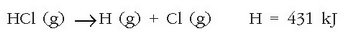
Lotura energia batez hitz egiten bada ere, normalean lotura entalpiak erabiltzen dira.
Zenbat eta handiagoa izan lotura energiaren balioa orduan eta sendoagoa izango da lotura eta, beraz, egonkorragoa, apurtzen zailagoa.
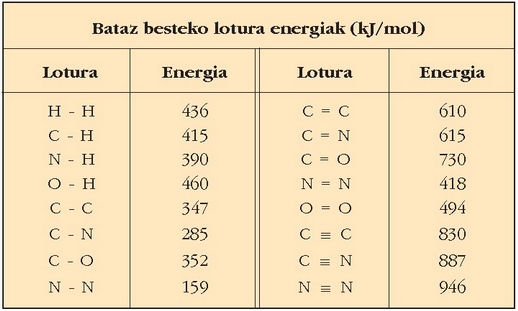
Ondoko taulan lotura energia arruntenak ikus daitezke. Bataz besteko energiak dira taulan ematen direnak,
ezin baita esan lotura jakin batek beti duela egonkortasun bera, lotura bera izan arren, lotura hori zein molekulatan dagoen,
ezberdina delako, oso ezberdina ez bada ere. Honela, C-C lotura ez da berdin-berdina etanoaren kasuan
 eta azido azetikoaren kasuan (H3C-COOH)
eta azido azetikoaren kasuan (H3C-COOH)
Bataz besteko lotura energietatik gasen arteko gutxi gorabeherako erreakzio entalpiak kalkula daitezke. Erreakzioan substantzia gotorrek edo solidoek eta isurkariek parte hartzen dutenean kalkulua ez da batere zehatza, molekulen arteko elkarrekintzak ere eragin handia duelako.
Etanoa ematen duen etilenoaren hidrogenazioa erreakzio honen bitartez gertatzen da:
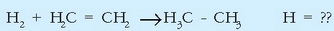
Taulan emandako lotura energien bidez erraz kalkula daiteke erreakzio entalpia. Horretarako, apurtzen diren loturak eta eratzen direnak hartu behar dira kontuan. Apurtzen diren loturen artean C = C eta H - H loturak daude, bietatik bana.
Eratzen direnen artean, berriz, C - C eta C - H loturak, lehenengo motako bat eta bigarren motako bi. Horiek horrela:

Emaitza, ona bada ere, ez da zehatza.
Erreakzio kimikoen berezkotasuna
XIX. mende amaieran zientzialariek uste zuten erreakzio exotermikoak bakarrik gerta zitezkeela berez. Erreakzio endotermikoak berez ezin gerta zitezkeen erreakzioak ziren. Horrela ote da hori?
Hala dirudi lehen begiratuan, erreakzio exotermikoak gertatzeko aski baita energia askatzea. Zailagoa dirudi alderantzizko prozesua berez gertatzea. Hala ere, erreakzio endotermiko asko daude berez gertatzen direnak giro tenperaturan. Amonio karbonatoa, adibidez, berez deskonposatzen da eta amoniakoa ematen du:
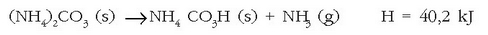
Ez da harritzekoa horrela izatea. Bizitza arruntean prozesu fisikokimiko asko, erreakzio endotermiko asko, gertatzen dira berez giro tenperaturan. Izotzaren fusioa, esaterako, ura ematen duen prozesu endotermikoa da, eta giro tenperaturan berez gertatzen da. Isurkariak besterik gabe lurrintzen dira giro tenperaturan, gatz askoren disoluzio prozesuak uretan endotermikoak dira, etab.
Gauzak horrela, bi aukera daude: prozesuen berezkotasuna ez da H-ar en funtzioa, ala beste funtzio bat ere badago prozesu horretan eragina duena. Hain zuzen ere, bigarren kasua da gertatzen dena, eta entropia, S, izena du erreakzioen berezkotasunean eragina duen funtzio horrek.
Sistema baten desordena mikroskopio bidez neurtzen duen magnitudea da entropia; zenbat eta desordena handiagoa, orduan eta entropia garaiagoa.
Ura lurrin bihurtzeko prozesuan desordena areagotu egiten da, eta entropia, beraz, handiagoa egiten da.
Edozein sistemak, esan daiteke, joera duela berez energia minimoko aldera iragateko baina desordena edo entropia maximoko egoerara joateko. Baina joera horiek elkarren kontrakoak izaten dira sarritan: prozesu batean entropia handiagoa egiten bada, gerta daiteke energia handiagora joatea edo alderantziz.
Magnitude termodinamiko bat badago bi joerak kontuan hartzen dituena: Gibbsen energia askea, energia askea besterik gabe edo, gutxiagotan, entalpia askea esaten zaio magnitude horri. Prozesu bati dagokion Gibbsen energia askearen aldaketa tenperatura eta presio konstantean hau da:
DISOLUZIO ENTALPIA
Amonio nitratoaren disolbatze prozesua endotermikoa dela frogatu nahi da irudi hauekin. Ontzian ura dago giro tenperaturan, kristalizadorean amonio nitratoa, eta ezkerraldean egur zatia, gainaldean ur tanta handi bat duela. Amonio nitratoa uretara bota eta gero, ontzia egurraren gainean jarriko da.
Bi gauza daude behatu beharrekoak: uraren tenperatura zerotik behera jaitsi da (uretan termometroa sartuz behatuko da hori) eta egurraren gaineko ura izoztu egin da; hori dela eta, ontzia egurrari itsatsita geratu da eta ontzia jasotzen badugu, egurra ere harekin batera jasoko dugu. Disolbatzerakoan, beraz, ur/amonio nitrato sistemak beroa hartu du ingurunetik (horregatik jaitsi da tenperatura eta izoztu da ura) eta horrek adierazten du prozesu hau endotermikoa dela.
Berezkotasunaren hitzarmenak
Prozesu bat exotermikoa bada H negatiboa da; gainera, prozesuan desordena areagotzen bada S positiboa izango da eta Gibbsen energia askearen aldaketa negatiboa: G < 0.
Orokorrean, termodinamikak erakusten duenez, prozesu bat berez gerta dadin, prozesuan jasandako Gibbsen energia askearen aldaketaknegatiboa izan behar du. Kontrakoa gertatuko balitz, alegia, prozesuan zehar Gibbsen energia askea handituko balitz, orduan prozesua ez litzateke berezkoa izango. Gibbsen energia askearen aldaketa zero den kasuetan, oreka dagoela esaten da prozesuko hasierako eta bukaerako gaien artean.
Goian aipatutako  delakoaren erreakzioari aplikatuko
diogu irizpide hori. Gauza jakina da H positiboa dela. Amonio
karbonatoa apurtu egiten denez eta, gainera, gas bat eratzen denez
(amoniakoa), entropia handiagoa egingo da prozesuan zehar.
Beraz, - T S negatiboa izango da eta G negatiboa ala positiboa
izango da, aipatutako terminoen balioen arabera. Jarritako adibidean
giro tenperaturan ere, termino entropikoa, T S, handiagoa
da entalpikoa baino, H; beraz, G negatiboa izango da eta prozesua
berezkoa.
delakoaren erreakzioari aplikatuko
diogu irizpide hori. Gauza jakina da H positiboa dela. Amonio
karbonatoa apurtu egiten denez eta, gainera, gas bat eratzen denez
(amoniakoa), entropia handiagoa egingo da prozesuan zehar.
Beraz, - T S negatiboa izango da eta G negatiboa ala positiboa
izango da, aipatutako terminoen balioen arabera. Jarritako adibidean
giro tenperaturan ere, termino entropikoa, T S, handiagoa
da entalpikoa baino, H; beraz, G negatiboa izango da eta prozesua
berezkoa.
Tenperaturaren eragina
Termino entropikoa eta entalpikoa elkarren kontrakoak direnean, gorago aipatutako erreakzioan bezala, tenperaturaren eragina garrantzi handikoa da erreakzioaren berezkotasunari dagokionez. Izan ere, gerta daiteke tenperatura jakin batean berezkoa den erreakzioa berezkoa ez izatea beste tenperatura batean.
Uraren deskonposaketa giro tenperaturan ez da berez gertatzen den erreakzioa; baina tenperatura altuagoetan, aldiz, uraren berezko deskonposaketa gertatzen da.
Tenperatura apaletan T txikia da eta - T S terminoa ere, beraz, txikia da. Orduan G eta H elkarr en antzekoak izango dira eta termino entalpikoak kontrolatuko du prozesuaren berezkotasuna: prozesua endotermikoa bada ( H > 0), prozesua ez da berezkoa izango; bai ordea kontrako kasuan, alegia, prozesua exotermikoa denean ( H < 0).
Tenperatura altuetan T handia da eta - T S terminoa handia izango da, termino entalpikoaz gaindikoa. Termino entropikoak kontrolatuko du prozesuaren berezkotasuna: tenperatura altuetan molekula handien deskonposaketa erraztuko du, molekula txikiagoak emateko.
Izarretan horregatik molekula txikiak eta sinpleak besterik ez daude eta gas monoatomikoak izan ohi
dira (H, He, etab.). Izarr en barnealdean, tenperatura  ingurukoa baita, atomorik ere egon
ez dago eta nukleoak eta elektroiak egoten dira (plasma egoera).
ingurukoa baita, atomorik ere egon
ez dago eta nukleoak eta elektroiak egoten dira (plasma egoera).
Eraketa energia askeak
Energia askeen arteko batura entalpien batura bezala betetzen da (Hess-en legea) eta horregatik entalpiekin egiten ziren kalkulu berberak egin daitezke energia askeekin ere. Era berean substantzia bakoitzak bere eraketa energia askea du, taulan ikus daitekeenez.
 balioak
konposatu baten egonkortasunaren balioa ematen du gaiaren elementuen egonkortasunarekiko.
balioak
konposatu baten egonkortasunaren balioa ematen du gaiaren elementuen egonkortasunarekiko.
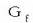 negatiboa denean konposatua egonkorra da, egonkorragoa zenbat eta balio negatibo handiagoa izan.
negatiboa denean konposatua egonkorra da, egonkorragoa zenbat eta balio negatibo handiagoa izan.
 positiboa denean,
ostera, konposatua ezegonkorra da.
positiboa denean,
ostera, konposatua ezegonkorra da.
 taulako balioak, H-aren balioak bezala, erreakzio energia askeak kalkulatzeko erabil daitezke.
taulako balioak, H-aren balioak bezala, erreakzio energia askeak kalkulatzeko erabil daitezke.
G-aren balioak erreakzioaren norabidea ematen du, erreakzioa zein aldetara abiatuko den, baina ez du ezer esaten lastertasunari buruz. Beraz, erreakzio baten berezkotasunak ez du zerikusirik erreakzioaren iraupenarekin. Erreakzio bat berezkoa izanik ere, urteak behar izan daitezke berau burutzeko.
Uraren eraketa erreakzioa hau da:
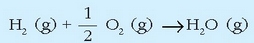
Eta bertan gertatzen diren entalpia eta entropia aldaketak, berriz, hauek dira: H = - 241,8 kJ eta S = - 44,4 J/K (denak 298 K- tan eta 1 atm-ko presioan). Erreakzioaren energia askearen aldaketa erraz kalkula daiteke adierazpen honen bidez:
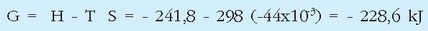
Balio negatibo eta altua. Horrek uraren eraketa, 25°C-tan bere elementuetatik abiatuz, guztiz berezkoa dela esaten du edo, beste era batera, ura oso konposatu egonkorra dela giro tenperaturan, gauza jakina den bezala.
Era berean erraz kalkula daiteke zein tenperaturatan izango den ezegonkorra ura. Uraren ezegonkortasuna G = 0 denean hasiko da. Baldintza hau erabiliz:

Beraz:
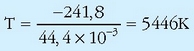
Oso tenperatura altua behar da ura ezegonkorra bihur dadin.







