Fisika-Kimika»Fisika - Kimika
Nola elkartzen dira atomoak molekulak sortuz?
Molekulak elkar daitezke?
Izadian dauden elementu edo substantzia kimiko sinpleen bitartez (90 inguru) substantzia natural zein artifizial
guztiak lor daitezke. Zerk lotuarazten ditu elementu horien atomoak elkarrekin? Sodioa (Na) eta kloroa (Cl),
adibidez, gatza (NaCl) osatuz elkartzen dira. Eta zergatik elkartzen dira beti modu jakin batean? Hidrogeno
atomoa (H) eta oxigeno atomoa (O), adibidez, bi modutara elkar daitezke bakarrik, edo ura
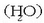 osatzeko edo ur oxigenatua
osatzeko edo ur oxigenatua 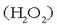 osatzeko; ez dira sekula elkartuko
osatzeko; ez dira sekula elkartuko 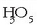 edo horrelakorik osatzeko. Bi atomo berdin ere elkar daitezke. Oxigeno atomoek, adibidez, edo
edo horrelakorik osatzeko. Bi atomo berdin ere elkar daitezke. Oxigeno atomoek, adibidez, edo
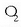 (oxigeno arrunta) edo
(oxigeno arrunta) edo 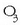 (ozonoa) osatzen dute elkarturik. Atomoek, beraz, kimika loturez elkartu, eta molekulak osatzen dituzte.
Beste era batera esanda, molekulak atomoz osaturik daude, atomo multzoak dira: azido sulfurikoaren lotura
(ozonoa) osatzen dute elkarturik. Atomoek, beraz, kimika loturez elkartu, eta molekulak osatzen dituzte.
Beste era batera esanda, molekulak atomoz osaturik daude, atomo multzoak dira: azido sulfurikoaren lotura
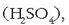 adibidez, zazpi atomoz osaturik dago (bi
atomo hidrogeno, atomo bat sufre eta lau oxigeno). Milaka atomoz
osaturiko molekulak ere badira: milaka karbono atomoz osaturik
daude, esate baterako, diamantea eta grafitoa. Plastikoen
molekulak ere milaka atomoz osaturik daude, baina diamanteak
ez-bezala, atomo mota desberdinez. Poli(metil metakrilato)-ak,
adibidez, karbono, oxigeno eta hidrogeno atomoak ditu. Zenbait
elementuren atomoak, ordea, hala nola helioa (He), neoia (Ne),
kriptoia (Kr)… ez dira besterekin lotzen, ez dute molekularik
osatzen, normalean ez, behintzat.
adibidez, zazpi atomoz osaturik dago (bi
atomo hidrogeno, atomo bat sufre eta lau oxigeno). Milaka atomoz
osaturiko molekulak ere badira: milaka karbono atomoz osaturik
daude, esate baterako, diamantea eta grafitoa. Plastikoen
molekulak ere milaka atomoz osaturik daude, baina diamanteak
ez-bezala, atomo mota desberdinez. Poli(metil metakrilato)-ak,
adibidez, karbono, oxigeno eta hidrogeno atomoak ditu. Zenbait
elementuren atomoak, ordea, hala nola helioa (He), neoia (Ne),
kriptoia (Kr)… ez dira besterekin lotzen, ez dute molekularik
osatzen, normalean ez, behintzat.
Lotura kimikoak
Arestian esan den bezala, kimika loturen bidez elkartzen dira atomoak molekulak osatzeko. Prozesu horretan berebiziko garrantzia dute elektroiek. Elektroiaren negatibotasuna eta nukleoaren positibotasuna direla eta, erakartze indarrak sortzen dira elektroien eta nukleoaren artean. Erakartze indar horiek nukleoen arteko (positiboak) aldentze indarrak baino handiagoak direnean, lotura kimikoa sortzen da nukleoen artean. Elektroiak dira gertaera horren eragile nagusiak. Elektroiek berek baino are garrantzi handiagoa dute oraindik elektroien kokapenak atomoaren egituran, batetik, eta elektroi kopuruak, bestetik, hau da, elektroi egiturak. Elektroi egitura nolakoa den, atomoak era batera edo bestera elkartzen dira molekulak osatzeko. Eta horren arabera, hainbat lotura mota bereiz daiteke: lotura kobalentea eta lotura ioniko, esate baterako.
Elektroiak arau jakin batzuen arabera kokatzen dira nukleoaren
inguruan; mailaz maila, energia maila edo geruza guztiak betez
doaz, beheko mailatik hasi eta goiko mailaraino. Elektroi guztiek
dute eragina loturetan, baina atomoaren nukleotik urrutieneko
energia mailan daudenak, hots, balentzia elektroiak, horiek arehandiagoa dute oraindik.
Helioarena izan ezik, gas geldo guztien (Ne, Ar, Kr, Xe) elektroi egitura berdina da:
 ;
helioarena
;
helioarena 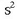 da.
Oso egitura egonkorrak dira, eta atomo guztiek dute elektroi egiturahori hartzeko joera.
Atomo batek elektroi egitura
da.
Oso egitura egonkorrak dira, eta atomo guztiek dute elektroi egiturahori hartzeko joera.
Atomo batek elektroi egitura  badu (kloroak, adibidez, hala du),
badu (kloroak, adibidez, hala du),  egitura egonkorra hartzera joko du. Egitura hori lortzeko, beraz, elektroi bat bereganatu beharko du,
elektroiren bat sobran duen beste atomo batetik hartu ere, sodiotik, adibidez, sodioaren elektroi egitura
egitura egonkorra hartzera joko du. Egitura hori lortzeko, beraz, elektroi bat bereganatu beharko du,
elektroiren bat sobran duen beste atomo batetik hartu ere, sodiotik, adibidez, sodioaren elektroi egitura
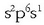 baita.
Sodioak eta kloroak elkartzeko darabilten lotura mota horri lotura ioniko deitzen zaio.
Baina bi atomok, elkartzeko, ez dute zertan elektroi egitura desberdina izan, bai baitago egitura berdineko bi atomo elkartzeko modua ere,
baldin eta bi atomok elektroi bana (edo bina, edo hiruna) partekatzen badute egonkortasuna lortzeko.
Lotura mota horri lotura kobalente esaten zaio. Horrela elkartzen dira kloro atomoak
baita.
Sodioak eta kloroak elkartzeko darabilten lotura mota horri lotura ioniko deitzen zaio.
Baina bi atomok, elkartzeko, ez dute zertan elektroi egitura desberdina izan, bai baitago egitura berdineko bi atomo elkartzeko modua ere,
baldin eta bi atomok elektroi bana (edo bina, edo hiruna) partekatzen badute egonkortasuna lortzeko.
Lotura mota horri lotura kobalente esaten zaio. Horrela elkartzen dira kloro atomoak
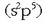 kloro molekula bat
kloro molekula bat
 osatzeko. Zailagoa da trantsizio egoeran dauden atomoen elektroi egiturek egonkortasuna
iristea, zeharo betegabeko mailak –d energia mailak– baitituzte
tartean. Horrelakoetan bost elektroi izateak ematen du elektroi
egiturarik egonkorrena.
osatzeko. Zailagoa da trantsizio egoeran dauden atomoen elektroi egiturek egonkortasuna
iristea, zeharo betegabeko mailak –d energia mailak– baitituzte
tartean. Horrelakoetan bost elektroi izateak ematen du elektroi
egiturarik egonkorrena.
Dena dela, eta gorago aipatu den bezala, zein nahi den eer elektroi egitura, atomoek egitura egonkorrena bilatzen dute beti, atomo egokienekin elkartuz. Lotura kobalentea eta lotura ionikoak, beraz, elkarrengandik urrutien dauden lotura motak dira, gainerako lotura mota guztiak horien tartean daude.
Lotura ionikoa
Metalen artean elektroi egitura desberdineko elementuak daude. Horietariko batzuk, sodioa, esate baterako, oso,
baina oso elektropositiboak dira  Hau da, gas geldoen elektroi egitura egonkorra
Hau da, gas geldoen elektroi egitura egonkorra  hartzeko joera dute, elektroi bat askatuz edo galduz.
hartzeko joera dute, elektroi bat askatuz edo galduz.
Beste elementuren batek elektroi hori har baleza, lotura ionikoa eratuko litzateke sodioaren eta delako elementu horren artean.
Kloroa elementu egokia da horretarako, 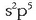 baitu elektroi egitura. Elektroi trukea egitean, bi atomoetako bat katioi (edo karga positibodun) bihurtuko da,
baitu elektroi egitura. Elektroi trukea egitean, bi atomoetako bat katioi (edo karga positibodun) bihurtuko da,
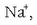 ,
eta anioi (edo karga negatibodun), aldiz, bestea,
,
eta anioi (edo karga negatibodun), aldiz, bestea,
 Kargak elkarren kontrakoak direnez, elkar erakarriko dute. Bi elementu lotarazi dituen lotura mota horri lotura ioniko
esaten zaio, ioiak sortu behar izan direlako aldez aurretik. Lotura ionikoa eratzen duten atomoetako batek elektropositiboa izan behar du,
eta elektronegatiboa, berriz, besteak, hau da, batek elektroiak galtzeko joera izan behar du, eta elektroiak hartzekoa, berriz, besteak.
Joera desberdintasun hori nabarmena da metalen eta ez metalen artean, edo, beste era batera esanda, elementuen taularen ezkerraldeko
eta eskuinaldeko elementuen artean.
Kargak elkarren kontrakoak direnez, elkar erakarriko dute. Bi elementu lotarazi dituen lotura mota horri lotura ioniko
esaten zaio, ioiak sortu behar izan direlako aldez aurretik. Lotura ionikoa eratzen duten atomoetako batek elektropositiboa izan behar du,
eta elektronegatiboa, berriz, besteak, hau da, batek elektroiak galtzeko joera izan behar du, eta elektroiak hartzekoa, berriz, besteak.
Joera desberdintasun hori nabarmena da metalen eta ez metalen artean, edo, beste era batera esanda, elementuen taularen ezkerraldeko
eta eskuinaldeko elementuen artean.
Ioi loturetan, elementuetako bakoitzak hartzen edo galtzen duen elektroi kopuruari elektrobalentzia (edo ioi balentzia) esaten zaio. Sodioarena, edo kloroarena, esate baterako, bat da.
Sodio positiboak inguruko kloro negatiboa erakartzen du, baina ez bakarrik bat, ahal dituen guztiak baizik; ahalmen hori sodioaren (eta kloroaren) tamainaren baitan dago. Kloroak sodio positiboak erakartzeko duen ahalmenaz ere beste horrenbeste esan daiteke. Kopuruak eta kokapenak forma berezia ematen diete horrelako konposatu ioikoei. Gatzak, adibidez, kubo itxura du: ioi bakoitzaren inguruan kontrako karga duten 6 ioi ditu (koordinazio indizea 6 duela esaten da). Material ioikoak, beraz, duten itxura geometrikoa dela eta, kristalinoak direla esaten da. Ondorioz, sodio kloruroaren molekula (NaCl), kristal egoeran, NaCl dela esatea ez da zuzena, izan, mugagabea baita.
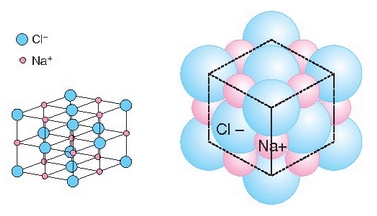
Ioien ordenamendua NaCl-aren kristaletan
Zesio kloruroa ere konposatu ioikoa da, atomo elkarketa ioi loturez egiten baitu. Zesioa eta sodioa, elektronegatiboak dira biak, bata bestea bezain, baina zesioa askoz ere handiagoa da tamainaz, eta hori dela eta, askoz kloro negatibo gehiago har dezake sodioak baino. Koordinazio indizea ere sodioak baino handiagoa du, zortzi (alegia, zortzi kloro negatibo izaten dira zesio baten inguruan). Substantzia horrek, aurrekoak bezala, kubo itxura du, baina ioiak desberdin kokaturik, irudietan argi ikusten den bezala.
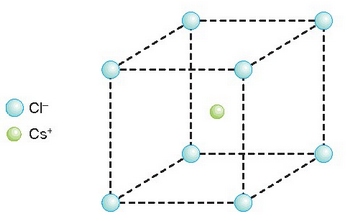
Ioien ordenamendua CsCl-aren kristaletan
Lotura kobalentea
Bi elementu elektronegatibo ez metalikoak lotura kobalentez elkartzen dira.
Biak elektronegatiboak izanik, biek dute, gehiago edo gutxiago, elektroiak hartzeko joera.
Elektroi bana (edo bina, edo hiruna) bientzat erabiliz konpontzen da arazoa. Bi atomo hidrogeno,
adibidez, lotura kobalentez elkartzen dira hidrogeno molekula osatzeko. Hidrogenoaren elektroi egitura
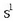 izanik,
bi atomoek dute, bestearen elektroia baliatuz, helio geldoaren elektroi egitura
izanik,
bi atomoek dute, bestearen elektroia baliatuz, helio geldoaren elektroi egitura
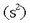 hartzeko joera.
Atomo bakoitzak bere elektroia eskaintzen du elektroi egitura hori lortzeko. Lotura mota horri, non bi atomoen zenbait elektroi
-elektro bikoteak- erabiltzen baita bientzat, lotura kobalentea esaten zaio. Beraz, elektroi bikote baten
(edo bi edo hiru elektroi bikoteren) bitartez egin daiteke lotura kobalentea. Elektroi bikote bakarrekoari lotura kobalente bakun esaten zaio,
bikoari bikoitza, eta hirukoari, noski, hirukoitza.
hartzeko joera.
Atomo bakoitzak bere elektroia eskaintzen du elektroi egitura hori lortzeko. Lotura mota horri, non bi atomoen zenbait elektroi
-elektro bikoteak- erabiltzen baita bientzat, lotura kobalentea esaten zaio. Beraz, elektroi bikote baten
(edo bi edo hiru elektroi bikoteren) bitartez egin daiteke lotura kobalentea. Elektroi bikote bakarrekoari lotura kobalente bakun esaten zaio,
bikoari bikoitza, eta hirukoari, noski, hirukoitza.

Oxigenoaren elektroi egitura 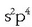 izanik, beste bi elektroi beharko ditu gas geldoaren egitura
izanik, beste bi elektroi beharko ditu gas geldoaren egitura
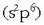 lortzeko.
Hidrogeno atomoak, bestalde, elektroi bat behar du egitura egonkorra lortzeko. Beraz, oxigeno atomo bat eta bi hidrogeno atomo izanda,
oxigenoak behar dituen bi elektroiak lortzen dira, batetik, eta bi hidrogenoak asetzen, bestetik. Hala, bada, bi elektroi
(bata oxigenoarena eta bestea hidrogeno batena) erabiliko dira lotura kobalente bat gauzatzeko. Oxigenoaren eta beste
hidrogenoaren artean ere antzeko lotura kobalentea eratuko da. Hidrogenoa eta oxigenoa, biak elektronegatiboak dira,
baina bat bestea baino gehiago, eta hori dela eta, biak elkartzen dituen lotura horri lotura kobalentea esaten bazaio ere, izan,
ez da lotura kobalente hutsa, lotura ionikoa ere bada zati batean. Lotura kobalente polarra esaten zaio gisako lotura horri.
lortzeko.
Hidrogeno atomoak, bestalde, elektroi bat behar du egitura egonkorra lortzeko. Beraz, oxigeno atomo bat eta bi hidrogeno atomo izanda,
oxigenoak behar dituen bi elektroiak lortzen dira, batetik, eta bi hidrogenoak asetzen, bestetik. Hala, bada, bi elektroi
(bata oxigenoarena eta bestea hidrogeno batena) erabiliko dira lotura kobalente bat gauzatzeko. Oxigenoaren eta beste
hidrogenoaren artean ere antzeko lotura kobalentea eratuko da. Hidrogenoa eta oxigenoa, biak elektronegatiboak dira,
baina bat bestea baino gehiago, eta hori dela eta, biak elkartzen dituen lotura horri lotura kobalentea esaten bazaio ere, izan,
ez da lotura kobalente hutsa, lotura ionikoa ere bada zati batean. Lotura kobalente polarra esaten zaio gisako lotura horri.
Lewis-en teoria lotura kobalenteari buruz
Lewis-en teoriaren arabera, bi atomo hurbiltzen direnean, gai dira - - gas geldo baten egitura egonkorra hartuz - lotura bat sortzeko bi atomoen artean elektroi-bikoteak partekatzen dituztela.
Hala bada, kloro molekula baten eraketa honelaxe adieraz daiteke Lewis-i jarraiki:
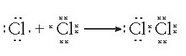
Atomo bakoitzak gas geldo baten egitura hartzen du prozesu horretan, zortzi balentzia elektroi eskuratuz. Horietariko elektroi batzuk atomoarenak berarenak dira (7) eta bat beste atomoarena, bi atomoen artean partekatzen dutena, hain zuzen. Beraz, 2 elektroi izango dira atomo bien artean partekatzen direnak.
Elektroiak ez dira, hortaz, atomo batetik bestera pasatzen; partekatu egiten dira zenbait elektroi bi atomoen artean. Kloroaren kasuan bi elektroi dira egoera horretan.
Partekatutako elektroi bikote bakoitzak –bi atomoen artean kokatzen da– lotura kobalente bat eratuko du. Ikus zenbait molekularen adibideak:
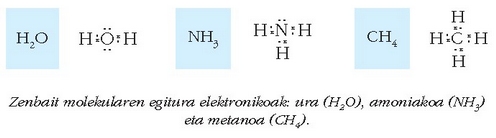
Zenbait molekularen egitura elektronikoak: ura (H2O), amoniakoa (NH3) eta metanoa (CH4).
Honelako diagramei, atomoen inguruko elektroiak puntu bidez adierazten direnei alegia, Lewis-en puntuzko diagramak esaten zaizkie.
Lotura kobalentea eratzen duen elektroi bikotea, marra baten bitartez adierazi ohi da sarritan:

Gas geldo baten egitura egonkorra lortzeko, zenbaitetan, ez da nahikoa izaten elektroi bikote bat partekatzea: bikote gehiago behar izaten dira. Horrelaxe sortzen dira –oxigenoan eta azetilenoan adibidez– lotura anizkoitzak:

Elektroi bikotea bi atomoren artekoa izan ordez, batek bakarrik eratua bada, orduan sortzen den loturari kobalente koordinatua esaten zaio. Irudia egiteko unean gezi bat erabili ohi da:

Lotura kobalente koordinatuaren eraketa H3O+ eta NHOAL(+;4) molekuletan. Loturak denak berdinak dira molekula bakoitzean baina batzuetan gezia jarri ohi da, horietariko bat koordenatua dela adierazteko.
Balentzia orbitalen teoria
Lewis-en teoriaren arabera honelaxe idatz daiteke hidrogeno molekularen eraketa:
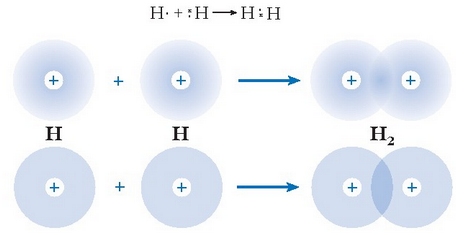
Hidrogeno molekularen lotura kobalentearen eraketa: goian, elektroien dentsitate hodeien arabera; behean, orbitalen arabera
Puntuzko diagrama bidezko irudi hau oso simplea da, baina ez da batere zehatza; itxuraz, elektroi bikotea bi atomoen artean kokatuta dago inongo mugikortasunik gabe; baina benetan ez da horrela: elektroi bikotea molekula osoan zehar mugitzen ari da. Bikoteak, dena dela, aukera handiagoa du atomoen artean egoteko beste inon baino. Esandakoa beste modu honetara adieraz daiteke: hidrogeno-atomoen 1s orbitalak elkarren gainean jartzen dira nukleoen arteko toki horretan (ikus irudia). Toki honetan (orbital berean, esan daiteke) elektroi biak egon daitezkeenez, Pauli-ren printzipioaren arabera, kontrako spina eduki behar dute. Bi orbital atomikoren gainezartze honek orbital molekular lekutua edo balentzia orbitala deritzona sortarazten du.
Hala bada, lotura kobalente bat era dadin, atomo biek elektroi desparekatu bana eduki behar dute eta lotura kobalentearen eraketa elektroi horien parekatzea besterik ez da izango:
Elementu baten kobalentzia elementu horrek duen elektroi desparekatu kopuruari esaten zaio eta sor dezakeen lotura kobalenteen kopuruaren berdina izango da.
Oxigenoaren kobalentzia, adibidez, 2 da eta ura eratzerakoan sortzen diren bi loturak, elektroiok parekatzerakoan sortzen dira:
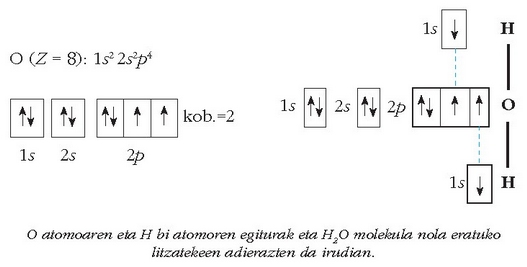
Nola liteke orduan, sufrearen kobalentzia 6 izatea zenbaitetan, honen balentzia elektroien egitura eta oxigenoarenak berdinak izanda?
Sufrearen kanpo-banaketa oxigenoarenaren berdina da
 ,
baina sufrearena
,
baina sufrearena  den bitartean, oxigenoarena
den bitartean, oxigenoarena  da.
Atomoen egituran 2d orbitalik ez dagoen arren, 3d orbitalak badaude, energia aldetik 3p eta 3s orbitalen oso antzekoak.
Hori dela eta, ez da zaila elektroiak pasatzea orbital batzuetatik besteetara, irudian ikusten den bezala:
da.
Atomoen egituran 2d orbitalik ez dagoen arren, 3d orbitalak badaude, energia aldetik 3p eta 3s orbitalen oso antzekoak.
Hori dela eta, ez da zaila elektroiak pasatzea orbital batzuetatik besteetara, irudian ikusten den bezala:
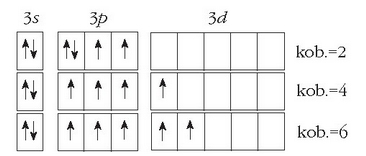
Sufreak hiru kobalentzia ezberdin eduki ditzake, ikusten den bezala.
Elektroiak egoera egonkorrenean geratuko balira, sufreak bi elektroi desparekatu edukiko lituzke eta bere kobalentzia 2 izango litzateke. Elektroi baten iragatea gertatzen bada, ostera, 3p orbital batetik 3d orbital batera, lau elektroi desparekatu edukiko lituzke sufreak eta bere kobalentzia 4 izango litzateke. Bi elektroi iraganez gero, 6 izango litzateke sufrearen kobalentzia. Baina oxigenoaren kasuan ezin da horrelakorik gertatu.
Beste horrenbeste gertatzen da karbono atomoarekin. Bere kanpo-egitura
 izanik,
kobalentzia 2 izango luke. Ikusi irudian nola uler daitekeen karbonoaren kobalentzia 4 izatea, elektroi bat iraganez,
2p orbital batetik 2p beste orbital batera.
izanik,
kobalentzia 2 izango luke. Ikusi irudian nola uler daitekeen karbonoaren kobalentzia 4 izatea, elektroi bat iraganez,
2p orbital batetik 2p beste orbital batera.
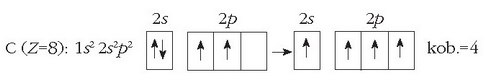
Karbonoak bi kobalentzia ezberdin eduki ditzake (2 ala 4), 2s orbitaleko elektroi bat non dagoen.
Boroaren kanpo-egitura 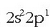 izanik, erraz ulertzen da kobalentzia 1 izatea. Baita 3 kobalentzia izatea ere elektroi baten transferentzia onartuz gero 2s orbitaletik 2p orbitalera.
izanik, erraz ulertzen da kobalentzia 1 izatea. Baita 3 kobalentzia izatea ere elektroi baten transferentzia onartuz gero 2s orbitaletik 2p orbitalera.
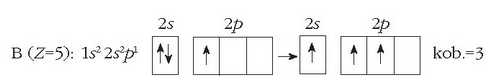
Boroak ere bi kobalentzia izan ditzake (1 ala 3) 2s orbitaleko elektroi bat non kokatzen den.
Kasu honetan balentzia orbital batzuk hutsik geratzen dira. Erreaktibotasun handiaren seinale da hau eta ezegonkortasun handiarena.
Molekulen geometria
Orain arte lotura kobalentea nola eratzen den ikusi da, zerk ematen dion gaitasuna atomo bati, beste atomo batekin elkar dadin.
Horrela, karbonoaren kobalentzia 4 izan daitekeela ikusi da eta gai dela
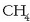 bezalako konposatua emateko.
Ez da ezer esan, ordea, atomoen kokapenari buruz, alegia, geometriari buruz.
bezalako konposatua emateko.
Ez da ezer esan, ordea, atomoen kokapenari buruz, alegia, geometriari buruz.
Balentzia orbitalen teoriaren arabera, molekularen geometria orbitalek izan ditzaketen norabideetan eta orbitalok gainezartzeko duten moduan oinarritzen da.
Adibide batzuekin erraz ulertuko da esandakoa.
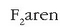 molekularen
geometria aztertzeko, esan den bezala, fluoroaren balentzia orbitalen norabideak hartu behar dira kontuan.
Fluoro atomoaren kanpo-egitura
molekularen
geometria aztertzeko, esan den bezala, fluoroaren balentzia orbitalen norabideak hartu behar dira kontuan.
Fluoro atomoaren kanpo-egitura 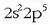 dela gogoratuz, beste aukerarik gabe, bere kobalentzia 1 izango da eta p orbitalean dagoen elektroiari leporatu beharko zaio
fluoro atomoak lotura kobalentea emateko duen ahalmena. Irudian ikus daitezke bi fluoro atomoen 2p orbitalak eta nola eratuko
litzatekeen lotura kobalentea. Ikusten den bezala fluoro atomoak lerroan jarri behar dira molekula eratzeko, eta sortzen den molekula lineala izango da.
dela gogoratuz, beste aukerarik gabe, bere kobalentzia 1 izango da eta p orbitalean dagoen elektroiari leporatu beharko zaio
fluoro atomoak lotura kobalentea emateko duen ahalmena. Irudian ikus daitezke bi fluoro atomoen 2p orbitalak eta nola eratuko
litzatekeen lotura kobalentea. Ikusten den bezala fluoro atomoak lerroan jarri behar dira molekula eratzeko, eta sortzen den molekula lineala izango da.
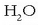 molekula
aztertzeko beste horrenbeste egingo da. Oxigeno atomoaren kanpo-egitura
molekula
aztertzeko beste horrenbeste egingo da. Oxigeno atomoaren kanpo-egitura
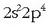 izanda,
ikusten da bere kobalentzia 2 dela; bi lotura kobalente emango ditu, beraz.
izanda,
ikusten da bere kobalentzia 2 dela; bi lotura kobalente emango ditu, beraz.

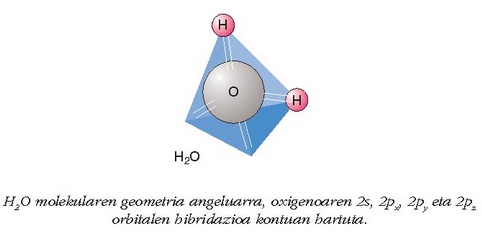
F2 eta H2O molekulen geometria (lineala eta angeluarra) atomoen orbitalak kontuan hartuta.
Irudian O atomoaren 2p orbitalak marraztu dira, dagozkien elektroiekin, eta
 kokatzeko –hastandura indarrak ahalik txikienak izan daitezen– ez
dago beste modurik, karbono atomoa tetraedroaren erdi-erdian dela,
orbitalak tetradroaren erpinen norabideetan kokatzea baino. Eta
hori da, hain zuzen ere, lau orbital hibridoek egiten dutena, tetraedroan
kokatu hastandurak txikienak izan daitezen. Ikus irudian
uraren tetraedro egitura:
kokatzeko –hastandura indarrak ahalik txikienak izan daitezen– ez
dago beste modurik, karbono atomoa tetraedroaren erdi-erdian dela,
orbitalak tetradroaren erpinen norabideetan kokatzea baino. Eta
hori da, hain zuzen ere, lau orbital hibridoek egiten dutena, tetraedroan
kokatu hastandurak txikienak izan daitezen. Ikus irudian
uraren tetraedro egitura:
Iksagun orain metanoaren geometria
 Esperimentu bidez ikusi da molekula hau tetraedro formakoa dela: karbono atomoa tetraedroaren erdi-erdian eta
lau hidrogeno atomoak lau erpinetan. Karbonoaren eta hidrogenoaren loturak ere denak berdin-berdinak dira,
nola sendotasunari hala beste tasun guztiei dagokienez. Baina geometria honen azalpena ezingo genuke,
uraren kasuan bezala, karbonoaren orbitalak besterik kontuan hartu gabe azaldu; horrela eginda, lau C-H
loturetatik hiru, p orbitaletan dauden elektroi desparekatuek sortuak, berdin-berdinak, eta elkarrekiko
elkarzutak izango lirateke. Laugarren lotura, ostera, desberdina izango litzateke, esperimentu bidez
ikusitakoaren aurka, s orbitaleko elektroi desparekatuak sortua delako, beste loturak ez bezala.
Arazo hau gainditzeko, uraren oxigenoaren kasuan egin den antzera, karbonoaren 4 orbitalak
(s orbital bat eta hiru p orbital ) hibridatu egingo direla joko da, 4 orbital hibrido,
Esperimentu bidez ikusi da molekula hau tetraedro formakoa dela: karbono atomoa tetraedroaren erdi-erdian eta
lau hidrogeno atomoak lau erpinetan. Karbonoaren eta hidrogenoaren loturak ere denak berdin-berdinak dira,
nola sendotasunari hala beste tasun guztiei dagokienez. Baina geometria honen azalpena ezingo genuke,
uraren kasuan bezala, karbonoaren orbitalak besterik kontuan hartu gabe azaldu; horrela eginda, lau C-H
loturetatik hiru, p orbitaletan dauden elektroi desparekatuek sortuak, berdin-berdinak, eta elkarrekiko
elkarzutak izango lirateke. Laugarren lotura, ostera, desberdina izango litzateke, esperimentu bidez
ikusitakoaren aurka, s orbitaleko elektroi desparekatuak sortua delako, beste loturak ez bezala.
Arazo hau gainditzeko, uraren oxigenoaren kasuan egin den antzera, karbonoaren 4 orbitalak
(s orbital bat eta hiru p orbital ) hibridatu egingo direla joko da, 4 orbital hibrido,
 deritzenak, emateko.
Orbital hibrido hauek, berdin-berdinak izateaz gain, tetraedro egitura edukiko dute. Horrela errazago ulertzen da esperimentu
bidez ikusitako metanoaren geometria. Ikus irudia: molekularen eraketa orbital hibridoen bitartez.
deritzenak, emateko.
Orbital hibrido hauek, berdin-berdinak izateaz gain, tetraedro egitura edukiko dute. Horrela errazago ulertzen da esperimentu
bidez ikusitako metanoaren geometria. Ikus irudia: molekularen eraketa orbital hibridoen bitartez.

Lotura metalikoa
Lotura metalikoan, lotura kobalentean ez bezala, parte hartzen duten elektroiak elkarketako bi atomoei loturik egoteaz gainera, etengabe mugitzen dihardute metala osatzen duten ioi positiboen artean. Elektroi guztiek dute antzeko ahalmena metaletan, eta metalen elektroi lainoa eratzen dutela esaten da.
Metaletan eta metalezko nahasteetan baizik ez da gertatzen lotura mota hau, baldintza hauek betetzen dituztenetan:
a) Ioitze energia txikia izatea, errazagoa baita horrela elektroiak askatzea eta elektroi lainoa eratzea. Atomoek karga positiboa hartzen dute.
b) Balentzia orbitalen bat hutsik izatea, elektroiak haietan zehar ibiltzea, metalaren alde batetik bestera.
Loturen polaritatea
Ioi loturetan elektroiak atomo batetik bestera igarotzen dira, atomo bat katioi eta bestea anioi bihurtuz. Lotura kobalenteen kasuan, ostera, elektroiak, bikoteka, bi atomoen artean kokatzen dira, bi-bien premiak asetuz. Baina atomoek duten elektroiekiko joera desberdina denean, loturan parte hartzen duten elektroiak atomo batera edo bestera gehiago hurbiltzen dira, atomo bat karga negatiboa duela eta bestea karga positiboa duela utziz zati batean. Halakoetan, atomoak elkartzen dituen lotura horrek polaritatea duela esaten da.
Lotura kobalente batzuk  –lotura
eratzen duten bi atomoak berdin-berdinak direnean eta, beraz, biak elektronegatiboak
direnean neurri berean– apolarrak dira. Loturako elektroi bikotea
ez da atomo baten zaleago izango bestearena baino.
–lotura
eratzen duten bi atomoak berdin-berdinak direnean eta, beraz, biak elektronegatiboak
direnean neurri berean– apolarrak dira. Loturako elektroi bikotea
ez da atomo baten zaleago izango bestearena baino.
Beste lotura kobalente batzuk, HCl molekularena adibidez, polarrak dira atomoak desberdinak direlako eta, kasu honetan, kloroak indar gehiagorekin erakartzen dituelako loturako elektroiak. Kloroak karga negatiboa izango du zati batean eta hidrogenoak partzialki positiboa. Karga desberdintasun hori dipolo elektrikoa neurtuz jakin daiteke; lotura baten dipolo elektrikoa, beraz, polaritatearen neurria da.
Lotura ionikoa, beraz, lotura kobalente polarraren muturreko egoera dela esan daiteke, eta egiune horren arabera, lotura kobalente guztiek lotura ionikoaren zatiren bat edukiko dute beti
Molekulen arteko indarrak
Elementuen atomoak, beraz, lotura kimikoen bidez molekulak osatuz elkartzen dira.
Zer gertatzen da molekulekin? Ba al da molekulak elkarraraz ditzakeen modurik edo loturarik?
Erantzuna baiezkoa da baina molekulak elkartzen dituen bitartekoari ez zaio lotura esaten
(hidrogeno lotura salbu) eta elkarketa molekulen arteko indarren bidez gertatzen dela esan ohi da.
Molekulen arteko indarrak nolakoak, halakoak izango dira eratzen dituzten substantzien egoera fisikoak.
Molekulen arteko indarrak sendoak dira uraren kasuan
 ;
horregatik ura isurkari edo likido egoeran dago giro tenperaturan. Haren oso antzekoa den hidrogeno sulfuroa
;
horregatik ura isurkari edo likido egoeran dago giro tenperaturan. Haren oso antzekoa den hidrogeno sulfuroa
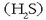 aldiz, gasa da tenperatura berdinean. Arrazoia molekulen arteko
indarrei leporatu behar zaie: handiak, uraren molekulen kasuan,
baina txikiak hidrogeno sulfuroarenean. Zenbaitetan atomoak ez
dira molekulak osatuz elkartzen eta orduan atomoen arteko indarrak
dira egoeraren erantzule; helioaren, neoiaren eta kriptoiaren
kasuak, esate baterako. Gas hauen atomo arteko indarrak beti dira
ahulak eta horregatik dira gasak hain zuzen, nola giro tenperaturan
hala askoz tenperatura baxuagoetan ere.
aldiz, gasa da tenperatura berdinean. Arrazoia molekulen arteko
indarrei leporatu behar zaie: handiak, uraren molekulen kasuan,
baina txikiak hidrogeno sulfuroarenean. Zenbaitetan atomoak ez
dira molekulak osatuz elkartzen eta orduan atomoen arteko indarrak
dira egoeraren erantzule; helioaren, neoiaren eta kriptoiaren
kasuak, esate baterako. Gas hauen atomo arteko indarrak beti dira
ahulak eta horregatik dira gasak hain zuzen, nola giro tenperaturan
hala askoz tenperatura baxuagoetan ere.
Atomoak molekulak osatzeko elkartzen direnean, kimika loturen bidez elkartzen dira. Molekulak ere lot daitezke elkarrekin, baina atomoen kasuan ez bezala, elkarketa ez da loturen bidez egiten, molekulen arteko indarren bidez baizik. Molekulak elkartzeko indar mota desberdinak daude, eta indar hori nolakoa den, handia edo txikia, solido egoeran, isurkari egoeran edota gas egoeran aurkituko dira substantziak. Hona orain hemen molekulen artean sortzen diren indar horietako batzuk:
Hidrogeno zubia
Elementuen taulan edo sailkapen periodikoan sail bereko elementuek antzeko ezaugarriak dituzte:
oxigenoak (O), sufreak (S), selenioak (Se) eta teluroak (Te), adibidez.
Hala ere, elementu horiez osaturiko beste gaien artean -ura
 ,
hidrogeno sulfuroa
,
hidrogeno sulfuroa 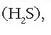 hidrogeno seleniuroa
hidrogeno seleniuroa 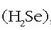 ,
eta hidrogeno telururoa
,
eta hidrogeno telururoa 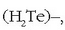 ,
bada bat gainerakoen tasunetik erabat aldentzen dena: ura, alegia. Aldera ditzagun taula batean substantzia horien fusio eta irakite tenperaturak:
,
bada bat gainerakoen tasunetik erabat aldentzen dena: ura, alegia. Aldera ditzagun taula batean substantzia horien fusio eta irakite tenperaturak:

Urak isurkari egoeran irauten duen tartea (100 °C) besteena baino askoz ere handiagoa da: 2,4 °C (hidrogeno sulfuroa), 22 °C (hidrogeno seleniuroa), eta 52,2 °C (hidrogeno telururoa). Bi ondorio atera daitezke hortik: ura errazago izozten da beste gaiak baino, baina nekezago irakiten du. Substantzia bat gotor dadin molekulak elkartu egin behar badira, eta, kontrara, lurrin dadin (gas bihur dadin) molekulak bereizi egin behar badira, garbi dago uraren molekulak erraz elkarganatzen direla eta, aitzitik, nekez bereizten direla. Arrazoi bakarra dago fenomeno hori azaltzeko: uraren molekulen arteko indarrak sendoagoak dira beste gaien molekulen artekoak baino. Uraren molekulen arteko indarrei hidrogeno zubi esaten zaie.
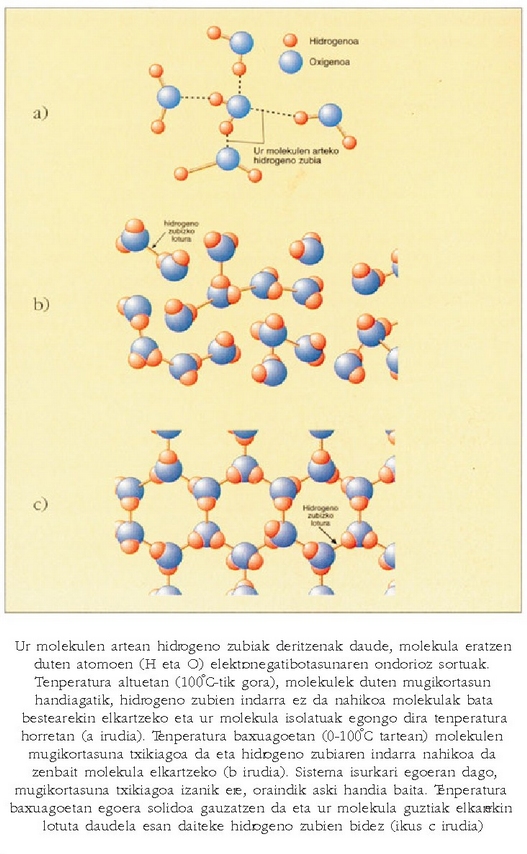
Oxigenoaren eta hidrogenoaren arteko lotura oso polarra da, oso elektronegatiboa baita oxigenoa hidrogenoaren aldean, eta karga desoreka bat sortzen da haien artean. Beraz, ez da harritzeko erakar - tze indar handia izatea molekula bateko oxigenoaren eta beste molekuletako hidrogenoaren artean. Molekulen arteko erakartze indar horretan hidrogenoak parte hartzen duelako esaten zaio indar horri hidrogeno zubia. Egia esateko, antzeko zerbait gertatzen da hidrogeno sulfuroaren molekulen artean eta arestian aipaturiko beste gai horien molekulen artean, molekula bateko hidrogeno, zati batez positiboak eta beste molekuletako sufre, zati batez negatiboak elkar erakartzen dutelako. Beste erakartze indar horri, hidrogenoak parte hartzen badu ere, ez zaio hidrogeno zubi esaten, bestea baino askoz indar ahulagoa baita, eta gainera, bereizi egin behar dira batetik bestera horrenbesteko aldea duten indarrak. Hidrogeno zubian, beraz, hidrogenoak hartu behar du parte, eta indarrak handia izan behar du. Gutxitan gertatzen da hori, bakarrik hidrogenoa oxigenoarekin edo fluoroarekin elkartuta dagoenean. Nitrogenoarekin eta kloroarekin ere izaten dira batzuetan erakartze indar sendoak.
van der Waals-en indarrak
Erraz ulertzen da nondik sortzen diren molekulen arteko erakartze indarrak polaritatea duten molekuletan, baina zer gertatzen da molekula apolarrekin? Substantzia bat, gas egoeratik isurkari egoerara igarotzeko, delako gaiaren molekulek elkartu egin behar dute, eta erakartze indarrak behar dira horretarako. Molekula apolarretan indar horiek nondik sortzen diren ulertzeko, helioa har daiteke adibide gisa. Helioa gas egoeran aurkitzen da izadian, atomo gisa aurkitu ere, gainera, ez molekula gisa, berez nahikoa egonkorra delako, era litzazkeen molekulak berak baino egonkorragoa. Esfera baten antzekoa da helioa, nukleoa eta bi elektroi dituela. Elektroiak etengabe mugitzen dira nukleoaren inguruan, eta aukera balego (ez dago baina prozesua argitzeko balio du) elektroiei argazkia egiteko, espazioan beti berdin banatuta daudela ikusiko litzateke. Nolanahi ere, elektroien mugimendua aleatorioa da, zorizkoa, eta gerta liteke elektroi biak espazioko leku berean, elkarrengandik hurbil, aurkitzea une batean. Une horretan, espazioaren alderdi horrek karga negatiboa hartuko luke, denbora tarte labur-labur batean bada ere. Beste alderdiak, berriz, karga positiboa izango luke. Kargen asimetria horrek karga desoreka bat sortuko du inguruko beste molekuletan. Lehenengo molekulak besteetan karga elektriko bat induzitu duela esango litzateke. Unehorretan erakartze indarra sor liteke molekula baten alderdi positiboaren eta beste baten alderdi negatiboaren artean. Indar horiek dira Van der Waalsen indarrak. Oso, baina oso indar txikiak dira. Izan ere, karga desoreka horiek ez dira inoiz oso handiak, eta oso gutxitan gertatzen dira, gainera. Horregatik da zaila horrelako substantzia bat isurkari edo solido bihurtzea; horregatik aurkitzen dira, giro tenperaturan direnean, gas egoeran.
Ikus taula honetan zenbait substantzia apolarren fusio eta irakite tenperaturak.

Zenbat eta elektroi gehiago izan molekula batek

 karga desorekak handiagoak dira,
eta handiagoak izango dira, beraz, erakartze indarrak ere; substantzia
horiek errazago bihurtuko dira isurkari edo solido.
karga desorekak handiagoak dira,
eta handiagoak izango dira, beraz, erakartze indarrak ere; substantzia
horiek errazago bihurtuko dira isurkari edo solido.
Linus Pauling
Linus Pauling Portlanden jaio zen, Oregonen (USA) 1901ean. Oregon State Collegen graduatu zen 1922an eta kimikako doktore egin zen 1925ean Kaliforniako Teknologia Institutuan. Bere ikasketak Europan sakondu ondoren, Kaliforniako Teknologia Institutuko irakasle izendatu zuten 1927an eta han jarraitu zuen irakasle izan zen bitartean.
Lotura kimikoaren izaera ulertzeko garrantzi handieneko ekarpen asko Paulingek eginak izan dira. Paulingek sartutako kontzeptu nagusien artean daude elektronegatibotasuna eta egitura erresonanteak (*). Pauling izan zen gas nobleek konposatuak eratu ahal izatea benetan hartu zuen kimikari gutxietako bat. 1939an lotura kimikoei buruz zituen ideiak argitaratu zituen, gero kimikako testu klasiko bihurtuko zen Lotura kimikoaren izaera liburuan. Liburu hori izan da, zalantzarik gabe, mende honetan kimikaren munduan eragin handiena izan duena. 1954an, kimikako Nobel Saria eman zioten, molekula egiturei buruz egindako lanagatik.
1950. hamarraldian, biopolimeroen egituren azterketari ekin zion Paulingek. Proteinen molekulak helize formakoak direla esan zuen aurrenekoetakoa izan zen. C bitaminazko dosi handiak katarrotik babesteko oso onak zirela ere baieztu zuen eta 1970etik aurrera kasu egiten hasi zitzaion medikuntza mundutik.
Bigarren Mundu Gerra amaitu zenean, Pauling desarme nuklearraren aldeko sutsu bihurtu zen. 1962an, Bakearen Nobel saria eman zioten, eta hala, historian bi Nobel Sari irabazi dituen bigarren pertsona bihurtu zen.
Molekula erraldoiak
Kloro atomoak, adibidez, binaka elkartzen dira lotura kobalenteen bidez molekula biatomikoak osatzeko.
Molekula horien artean Van der Waalsen indarrak daude, ahulak oso, baina tenperatura asko beheratuz gero,
elkartu eta isurkari edo solido egoerara igarotzeko gai dira. Bi atomo hidrogeno, atomo bat sufre eta lau
atomo oxigeno loturen bidez elkar daitezke azido sulfuriko molekulak osatzeko
 Molekula horien artean dauden erakartze indarrak kloro molekulen artekoak baino sendoagoak dira, eta beraz,
azido sulfurikoa erraz igaro daiteke isurkari egoerara (giro tenperaturan ia isurkari da) edo solido egoerara.
Molekula horien artean dauden erakartze indarrak kloro molekulen artekoak baino sendoagoak dira, eta beraz,
azido sulfurikoa erraz igaro daiteke isurkari egoerara (giro tenperaturan ia isurkari da) edo solido egoerara.
Molekula bat atomo gutxiz osatua al dago beti? (Kloro molekulak bi atomo besterik ez ditu, eta azido sulfurikoak zazpi). Ez, da erantzuna. Diamantean, adibidez, karbono atomo bakoitza beste lau atomo karbonorekin elkartzen da loturen bidez eta lau horietariko bakoitza beste laurekin, eta abar, amaierarik gabe. Miloika atomo karbono elkar daitezke, beraz, loturen bidez, molekula erraldoiak osatzeko. Horrelako molekulek ez dute hotzaren beharrik solido egoerara igarotzeko, atomo guztiak ia berez bezala baitaude bata bestearekin elkarturik. Isurkari edo gas egoerara igarotzea, ordea, zailagoa da, hautsi egin behar direlako karbonoen arteko loturak, oso sendoak.

Silizearen egitura kristalinoa
Silizea da diamantea bezalako beste substantzia bat. Silizioz (Si) eta oxigenoz (O) osatua dago. Silizio bakoitza lau oxigenorekin elkarturik dago loturen bitartez, eta oxigeno horietako bakoitza beste silizio batekin, eta abar, bukaerarik gabe. Silizea, beraz, solido egoeran aurkitzen da giro tenperaturan, eta oso zaila da isurkari edo gas egoerara igaroaraztea.
Gatza (sodio kloruroa) da beste adibide bat. Lotura ionikoa eratzen da Na + eta Cl - artean, baina horietariko bakoitza beste seirekin lotzen da, eta horrela etengabe, kubo egitura eratuz. Ioiz osaturiko molekula erraldoi bat eratzen da kasu honetan ere, eta aurrekoak bezala, oso fusio tenperatura handiko substantzia da.
Plastikoak dira gisako beste substantzia batzuk. Hain handiak izan gabe ere, milaka atomo elkartuz osaturik daude. Karbonoa (C), oxigenoa (O) eta hidrogenoa (H) elkartzen dira askotan horrelako molekuletan, baina ez dira elementu horiek bakarrik plastikoen eraketan parte har dezaketenak. Molekulak hidrogeno zubien edo Van der Waalsen indarren bidez elkartzen dira. Arestian esan bezala, azkeneko horiek oso indar ahulak dira, baina plastikoaren molekulak handiak direnez, indar handi samarra sortzen da haien artean, eta tenperatura handia behar izaten da –ez hala ere goraxeago aipaturiko gaiek adina– substantzia isurkari edo likido bihurtzeko. Plastikoak, beraz, solidoak dira giro tenperaturan.
Kristal isurkariak
Kalkulagailuen pantailetan, erlojuetan, termometro digitaletan etab. gai berezi bat erabiltzen da gaur egun: kristal isurkaria. Kristal isurkaria isurkari egoeran dagoen bitartean haren molekulak, kristalenak ohi bezala, ordena jakin baten arabera antolatzen dira. Kristal isurkariak, beraz, gai isurkarien eta gai gotorren tasunak gordetzen ditu aldi berean, eta hori dela eta, mesofase (grekeraz tarteko itxura) egoeran dagoela esaten da.
Kristal isurkari ohikoaren molekulak espageti baten itxura du. Espagetiak elkarren paralelo ordena daitezkeen bezala, kristal isurkariaren molekulak ardatzaren inguruan bira daitezke, edo elkarren inguruan mugi daitezke, paralelo mantenduz. Kristal isurkariaren beste molekula batzuek, berriz, xafla itxura dute. Zein gai den eta zein tenperaturatan dagoen, hiru mesofase mota bereiz daitezke molekulan: fase nematikoa, kolesterikoa eta esmetikoa. Batetik bestera materiaren ordenamendua handiagoa da.
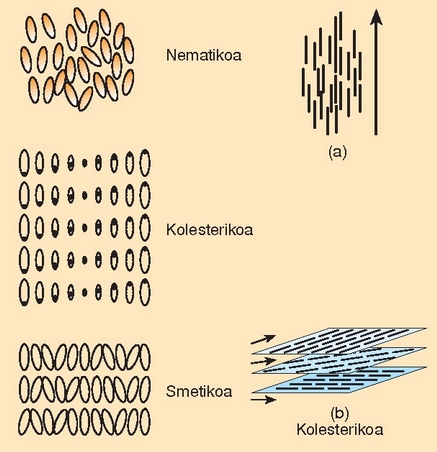
Kristal isurkariaren garrantzia bere tasun optiko bitxietan datza. Haren molekulak ordenaturik daudenez gero, X izpiak difraktatzen dituen kristal baten antzeko portaera izango dute molekula ordenatu horiek, eta horrenbestez argia difraktatuko dute. Tenperatura berean, argia difraktatzean, uhin luzera jakin bateko (kolore jakin bateko) argia ikusten da, baina tenperatura aldatzean molekulen ordenamendua aldatu egiten da, eta bestelako uhin luzera duen argia difraktatzen da (beste kolore batekoa, hain zuzen ere). Horregatik dira kristal isurkariak tenperaturaren gorabeherekiko sentiberak. Medikuntzan, adibidez, zainak aurkitzeko erabili daitezke, zain baten gaineko larruazala beroxeago egoten baita ingurukoa baino.
Tenperaturak ez ezik eremu elektrikoak ere eragin dezake tasun optiko hori aldatzea. Kristal isurkarizko xafla mehe bat bi elektrodoren artean ipini eta potentzial diferentzia aplikatu ondoren, molekulak beste era batera antolatuko dira, eta kristal isurkari gardena kristal isurkari opako bihurtuko da. Horregatik erabiltzen dira kristal isurkariak pantaila digitaletan. Aplikatu beharreko DV oso txikia da eta, gainera, kontsumo apaleko gailuak dira. Kristal isurkarien artean garrantzi handia dute gaur egun material polimerikoek, hau da, kristal isurkari polimerikoak.
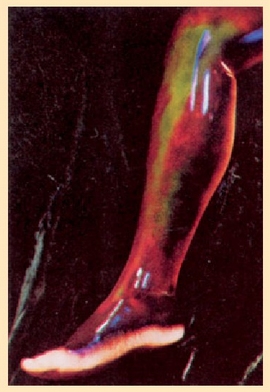
Irakurgaia
«— Gazte! Gazte! —esan zion monjeak triste samar— zer dela eta horrelako nekeak bidelagun baten bila? Zergatik ez duzu zeure bakardadea estimatzen eta onartzen zeruak ematen dizun aukera zeure gogoa bakean ikusteko? Zergatik gustatzen ote zaie elektroiei hainbeste munduko algara hori? Baina, norbatekin egoteko horrelako grina baduzu, lagunduko dizut, bai, zeure nahi hori asetzen. Hatzarekin erakusten dizudan aldera begiratzen baduzu, kloro atomo bat ikusiko duzu. Guregana dator eta gauden lekutik erraz ikusten da baduela leku bat libre; ondo hartuko zaituzte, ez izan zalantzarik. Leku libr ea elektroi multzoaren kanpoko aldean dago, «M maila elektronikoa» deritzon tokian; zortzi elektroi ikusi behar genituzke bertan, lau bikotetan kokatuak, baina ikusten den bezala zazpi besterik ez daude, lau alde batera biraka eta hiru beste aldera. Horien artean dago leku librea. Barruragoko geruzak, K eta L deritzenak, guztiz beteak daude eta atomoak pozik asko har - tuko zaitu altzoan, horrela kanpoko geruza ere betetzeko. Atomoa gerturatzen denean, jauzi txiki bat egin besterik ez duzu, balentzia elektroiek egiten duten bezala; eta joan bakean! — zertxobait lasaiago sentitu zen Tompkins jauna. Indar guztiak prest zituen orduantxe pasatzen ari zen kloro atomora salto egiteko. Harrituta geratu zen, erraz egin zuen jauzi eta gustora sentitu zen kloroaren M geruzaren giro lasaigarrian»
……
«— Zergatik ez du alde egiten utzi berri duzun atomo horr ek? –galdetu zion alboko lagunak, bekozkoa beltz–. Zu berriz noiz itzuliko zain ote dago?
Eta halaxe zen, sodio atomoa, balentzia elektroia galdu berri zuena, kloro atomoaren ondo-ondoan geratu zen: Tompkins jaunak iritzia aldatu eta utzitako atomoko orbital bakartira noiz itzuliko zain balego bezala.
— Bejondeiola! Hori azala!, –esan zuen Tompkins-ek haserre, keinu bat eginez hain gogo hotzarekin hartu zuen atomoari–. Ez jan egiten du eta ez jaten utzi!
— Betikoa. Horixe egiten dute beti —esan zuen esperientzia handiagoa zuen M geruzako batek—. Ez dira elektroiak zu joan zaitezen nahi dutenak, sodioaren nukleoa da, nik uste, horren bila dabilena. Gehienetan ez dira bat etortzen nukleoa eta hari jarraikiz doazen elektroiak: nukleoak bere karga elektrikoarekin eutsi dezakeen beste elektroi eduki nahi du bere inguruan; elektroiek, aldiz, ahalik eta gutxien eta hobe. Banaka batzuk besterik ez daude atomoen artean, adostasun handia dutenak; gas geldoak edo nobleak dira, horrelaxe esaten diete behintzat kimikari alemaniarrek. Helio, neoi eta argoi atomoak, adibidez, oso pozik eta gustora daude eur en buruarekin eta ez dute inoiz inor kanpora bidaltzen; ez eta inori gonbitik egiten ere eurekin joan dadin. Kimikoki geldoak dira eta ez dute beste atomoez ezer jakin nahi. Beste atomo guztiek, ostera, beti gertu daude bat edo beste trukatzeko.
La investigación del átomo, Fondo de Cultura Económica