Fisika-Kimika»Fisika - Kimika
Atomoaren egitura
XIX. mendearen hasieran John Dalton fisikari, matematikari eta kimikari ingelesak (1766-1844) teoria atomiko bat proposatu zuen, eta esperimentu bidezko neurketa asko eta asko egin ondoren, materia atomoez osaturik zegoela onartu zuen. Avogadro kimikari italiarrak (1776-1856) atomo eta molekula kontzeptuak bereizi zituen, eta bolumenen arteko proportzioak aztertu zituen gasen arteko erreakzioetan, bai eta aurkitu ere, besteak beste, gas desberdinetako bolumen berdinek, tenperatura eta presio berean, molekula kopuru bera zutela. Daltonen arabera atomoak zatiezinak ziren, eta izan, horrela zen berak aztertu zituen erreakzio kimikoetan. Izan ere, laboratorioan ari den kimikari batentzat atomoak zatiezinak dira, halakoxea baitute portaera. Nolanahi ere, zenbait esperimenturen emaitzek zalantzan jarri zuten zatiezintasun hori. Hala beraz, esperimentu horien arabera –elektrolisia, gasetako deskargak, eta erradioaktibitatea, besteak beste–, gorputz konplexua da atomoa, eta partikula txikiagoez osatua dago.

Galvani-ren pila.
Elektrolisia
XIX. mendearen hasieran sir Humphry Davy fisikari eta kimikari ingelesak (1778-1829) zera aurkitu zuen, korronte elektrikoa zenbait sustantziatan zehar igaroaraztean sustantzia horiek deskonposatu egiten zirela. Horretan oinarriturik ondorio hau atera zuen: konposatu (edo gai elkartu) kimiko baten elementuei (edo substantzia sinpleei) indar elektrikoek eusten diete elkarrekin loturik. H. Davyren ikasle Michael Faradayk finkatu zituen elektrolisiaren legeak, Faradayren legeak deituak.
Elektrolisia gerta dadin, ontzi batean bi elektrodo sartzen dira, erreakzio kimikoa emango duen sustantzia batean murgildurik, korronte jarraitu batera konektaturik daudela elektrodoak. Zirkuitu elektrikoa ixten denean, igarotzen den korronteak erreakzio kimikoa eragingo du, eta sortzen diren ioiak haien kontrako karga duen elektrodoan itsatsiko dira.
– Elektrodoan itsatsitako masa kantitatea disoluzioan zehar igaroarazten den elektrizitate kopuruaren araberakoa izango da.
– Prozesu horretan, soluzioko atomoek irabazi edo galdu egiten dute elektrizitatea.
Gasen eroankortasuna aztertzeko zenbait esperimentu
Gasak –airea, adibidez– elektrizitate eroale txarrak dira, baina presio oso apaletan eremu elektriko sendoa aplikatzen zaienean eroale bihurtzen dira. Eroamen elektriko hau egoki aztertzeko, hodi berezi bat erabili behar da, izpi katodikoen hodia, hain zuzen.
Hodi horretan bi elektrodo daude: bata, anodoa, sorgailuaren adar positiboari lotua, eta bestea, katodoa, adar negatiboari lotua. Hodian hutsunea egin (presioa, 5 mm Hg) eta tentsio altua aplikatu (milaka volt) ondoren, gasak korronte elektrikoa igarotzen uzten du, eta argia igortzen du. Zer gas mota erabiltzen den, kolore bateko edo besteko argia sortuko da. Presioa are gehiago gutxitzean (0,001 mm Hg), ordea, argia desagertu eta hodia ilundu egingo da, baina, hala ere, izpi batzuk ikusgai izango dira katodotik anodorantz doazela. Izpi horiek –katodotik ateratzen direlako, izpi katodikoak deituak– hodiaren paretarekin talka egitean fluoreszentzia eragiten dute. Eremu magnetiko eta elektrikoen eraginez izpiak desbideratu egiten direla frogatu ahal izan da.

Izpi katodikoen esperimentua
Joseph John Thomson fisikari ingelesak (1856-1940), izpi katodikoekin egin zituen esperimentuetan, partikula negatibo horien abiadura eta karga/masa zatidura neurtu zituen. Hodi barruko metala eta gasa edozein izanda ere, izpi horien izaera ez zela aldatzen

Thomson-en eredu atomikoa: ingurune jarrai positiboan (kolore gorrixkakoa) karga negatiboak (urdinak) tartekatuta, plum-cake baten antzera
frogatu zuen.
1897an izpi katodikoak partikula negatiboak zirela zehaztu zuen eta elektroi deitu zien
(izen hori bera jarri zien Geor - ge J. Stoney fisikari irlandarrak (1826-1911) 1891n);
elektroiak atomo guztietan zeudela eta oso-oso txikiak –edozein atomo baina askoz ere txikiagoak– zirela frogatu zuen.
1909an Robert Millikan fisikari estatubatuarrak (1868-1953) elektroiaren karga neurtu zuen, eta haren masa ezagutu ahal izatea lortu zuen horrela.
Gaur egun balio hauek onartzen dira: 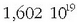 Coulomb eta 9,1095 10-31 kg.
Coulomb eta 9,1095 10-31 kg.
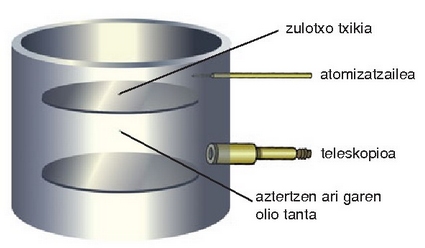
Millikan-en olio tantaren esperientzia: xaflen arteko tentsio elektrikoa (DV) handitutakoan, kargadun tanta mantsoago eroriko da (xafla positiboak erakarriko baitu). Tantaren gaineko grabitatze indarra eta indar elektrikoa berdintzen direnean (zeinuz aurkakoak dira) tanta gelditu egingo da.
Erradioaktibitatea
1896an, Thomson elektroiaren inguruko lanetan buru belarri ari zelarik, Antoine-Henri Becquerel fisikari frantziarrak (1852-1908) erradioaktibitatea aurkitu zuen ustekabean. Becquerelek argazki xafla batzuk zituen laboratorioan paper beltzez estalirik, eta, ohar - kabean, uranioa zuen substantzia bat utzi zuen paperen gainean. Xaflak errebelatu zituenean uranioak ukitutako zatia lausotua ageri zen: horrek esan nahi zuen uranioak paper beltza zeharkatu eta xaflaraino iritsi zen irrada motaren bat igorri zuela. Gertaera horren ikerkuntza Maria Sklodowska (1867-1934) eta Pierre Curie (1859-1906) senar-emazteek burutu zuten. 1903an Curie senar-emazteek eta Becquerel-ek Fisikako Nobel saria lortu zuten eta 1911n Marie Curiek Kimikako Nobel saria.
Rutherforden esperimentua
Elektrolisia, gasetako deskargak eta erradioaktibitatea kontuan harturik, atomoa ez zela ezin
zatituzkoa pentsatzen hasi ziren garai hartako zientzilariak. Atomoan beste partikula txikiagoak zeuden,
eta atomoaren izaera elektrikoa argitu behar zen, gainera. 1910ean Ernest Rutherford fisikari ingelesak (1871-1937)
eta bere taldeak - Hans Geiger alemaniarra (1882-1945) tartean - garrantzi handiko esperimentu bat egin zuten
atomoaren izaera hobeto ulertzeko. Metalezko hainbat xafla (urrea, zilarra, aluminioa.... etab.)
 partikulez bonbardatu zituzten.
Partikula horiek sustantzia erradioaktiboek igorritako partikula positiboak ziren. Metal xaflaren atzean zink sulfurozko
pantaila bat jarri zuten, metala zeharkatu ondoren
partikulez bonbardatu zituzten.
Partikula horiek sustantzia erradioaktiboek igorritako partikula positiboak ziren. Metal xaflaren atzean zink sulfurozko
pantaila bat jarri zuten, metala zeharkatu ondoren 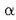 partikulak nola barreiatzen ziren ikusteko.
partikulak nola barreiatzen ziren ikusteko.
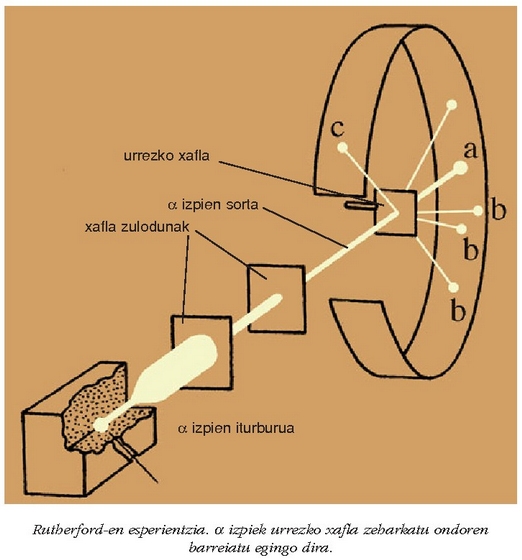
Pantailaren gainean barreiatutako distirak aztertuta, ondorio hauetara iritsi zen Rutherford:
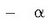 partikula gehien-gehienek
ibilbidea aldatu gabe zeharkatu zuten metal xafla (a).
partikula gehien-gehienek
ibilbidea aldatu gabe zeharkatu zuten metal xafla (a).
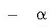 partikula bakan batzuek ibilbidea aldatu zuten pixka bat (b).
partikula bakan batzuek ibilbidea aldatu zuten pixka bat (b).
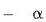 partikula gutxi-gutxi
batzuk xaflaren kontra talka egin eta atzera itzuli ziren (c).
partikula gutxi-gutxi
batzuk xaflaren kontra talka egin eta atzera itzuli ziren (c).
Horiek horrela, Rutherfordek hau proposatu zuen:
- Atomoaren zatirik handiena hutsik dago (horregatik ez ziren
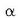 partikulak desbideratzen).
partikulak desbideratzen).
 partikula gutxi batzuek
errebote egiten bazuten, atomoaren masa gehiena gune jakin batean kontzentraturik zegoela esan nahi zuen.
partikula gutxi batzuek
errebote egiten bazuten, atomoaren masa gehiena gune jakin batean kontzentraturik zegoela esan nahi zuen.
- Gune horrek, masa gehiena edukitzeaz gainera, karga positiboa behar zuen.
- Gunetik tarte handi batera partikula negatibo arinak zeuden (elektroiak).
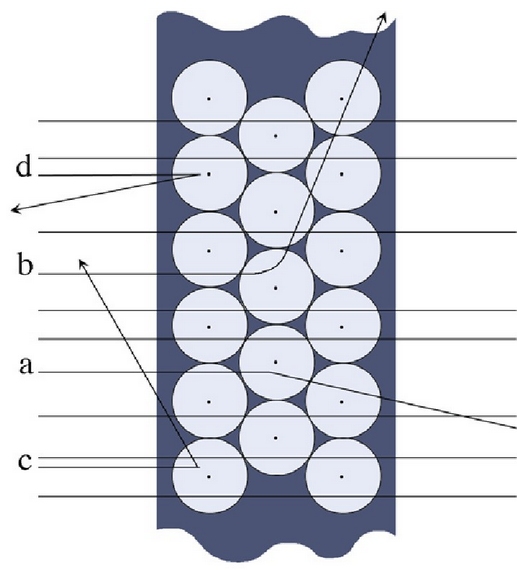
Rutherforden esperientziaren ondorengo emaitzen interpretazioa: atomoaren zatirik handiena hutsik dago. Bere zentruan masa gehiena bildurik dago nukleo trinko eta positiboki kargaturik dagoen batean eta bere inguruan elektroiak dauzkagu.
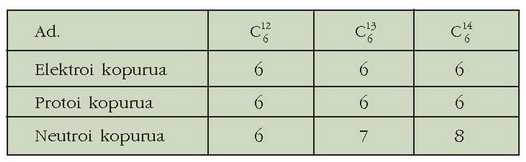
Karbonoaren isotopo ezberdinak
Rutherforden ereduaren arabera atomoa planeta sistemaren antzekoa litzateke: erdian gunea (eguzkia) eta inguruan elektroiak (planetak) biraka. Partikulen desbideratzeak neurtuta gunearen masa eta kargari buruzko datuak lortu zituen. Elektroien masa ia 1.900 aldiz txikiagoa zen partikula positiboena baino, eta, beraz, atomoaren masa gunearen masa bera zela esan zitekeen. Partikula positiboei protoi izena eman zitzaien.
Neurtze asko egin ondoren, Rutherford ohartu zen gunearen masa ez zetorrela bat protoien baturarekin. Bi aukera zegoen hori azaldu ahal izateko: edo gunean elektroi batzuk egotea, edo kargarik gabeko partikula pisudunak egotea. Berak bigarren aukera proposatu zuen. 1930ean Walther Bothe (1891-1957) eta Becker fisikari alemaniarrek aurkitu zituzten partikula neutro horiek, eta 1932an James Chadwick (1891-1974) fisikari ingelesak neutroi izena jarri zien. Neutroia kargarik gabeko partikula da, eta protoiarena baino masa handixeagoa du.
Atomoaren egitura hori kontuan harturik, kimikaren oinarrizko kontzeptu batzuk definitu dira:
Atomo zenbakia (Z): elementu edo gai bakun baten protoi kopurua (elektroi kopuruaren berdina, elementua neutroa baita)
Masa zenbakia (A): guneko protoi eta neutroien batura.
Elementua bat ala beste bat izatea, atomo zenbakiak zehazten du. Hau da, atomo zenbaki berbera duten bi elementu, elementu ber - dina dira. Atomo guztien guneetan neutroiak daude (hidrogenoaren formarik arruntenean izan ezik). Baina elementu gehienetan, elementu berdinaren nukleoek neutroi kopuru desberdina izan dezakete, hots, masa zenbaki desberdina, atomo zenbakia berdina izanda ere. Atomo horiei isotopo esaten zaie. Adibidez, hidrogenoaren hiru isotopo desberdin ezagutzen dira: guztiek protoi bakarra dute gunean, baina hidrogenoaren forma arruntak ez du neutroirik, deuterioak neutroi bakarra du eta tritioak, berriz, bi.
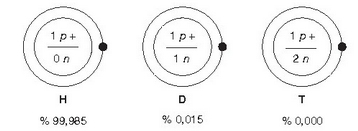
Hidrogenoaren isotopoak eta euren arteko proportzioa naturan
Notazioari dagokionez, isotopo desberdinak adierazteko, elementu kimikoaren sinboloa idazten da, eta sinboloaren ezkerrean, goi indize gisa, masa zenbakia (A), eta, azpi indize gisa, atomo zenbakia (Z).
Bohrren eredu atomikoa
Rutherforden ereduak dioenez, elektroiak biraka ari dira gunearen inguruan. Geldirik baleude, elektroien (negatiboa) eta protoien (positiboa) arteko erakartze indarrek elkarrengana bilduko lituzkete, eta elektroia gunearen gainera eroriko litzateke. Baina eredu horrek akats nabarmen bat du: irrada elektromagnetikoaren teoria klasikoaren arabera, azelerazioa duen partikula elektriko batek (eta elektroiak badu, biraka ari baita) irrada elektromagnetikoa igortzen du eta, beraz, energia galduz doa. Azkenean, energia erabat galduta, gunearen gainera eroriko litzateke. Nola liteke, orduan, elektroiak biraka aritzea gunearen inguruan gainera erori gabe?
Galdera horren erantzuna Niels Bohr fisikari danarriak (1885-1962) aurkitu zuen. 1913an bere atomo eredua proposatu zuenean, arrakasta handia izan zuen, hidrogenoaren espektro atomikoa azaltzea lortu baitzuen. 1922an Fisikako Nobel saria jaso zuen.

Niels Böhr (1885-1962).
Espektro atomikoak
Argi zuria beirazko prisma batean zehar igarotzean, ortzadarraren koloreak dituen irudia (espektro jarraitua) eratzen dute argi izpiek. Kolore bakoitza maiztasun jakin bateko irrada bat da. Kolore urdinak du maiztasunik handiena (baita energia handiena ere), eta gorriak, aldiz, txikiena. Espektroskopioaren bidez aztertzen dira irradak. Gas egoeran dagoen elementu batek ere, berotutakoan, edo beste era batera kitzikatutakoan, irrada elektromagnetikoa igortzen du; hori da elementu horren igortze espektroa. Espektro horiek elementu bakoitzaren bereizgarriak dira, haien hatz markakdirela esan daiteke. Atomoek sortzen dituzten espektroak ez dira jarraituak, etenak baizik: kolore argiko lerro batzuk, tartean ingurune beltzak dituztela.

Espektro horiek esplikatzeko egin ziren ahalegin guztiek porrot egin zuten Bohrren eredua iritsi zen arte. Niels Bohrrek 1913an Rutherforden atomo ereduari Max Planck fisikari alemaniarraren (1858-1947) teoria kuantikoa aplikatu zion. Materiak berotzean igortzen duen irrada aztertu zuen Planckek, eta ondorio hau atera zuen: energia ez da magnitude jarraitua, hots, ezin da energiaren edozein balio transferitu, galdu ala irabazi. Energiaren unitaterik txikiena quantuma izango litzateke. Gorputz batek xurgatu edo igorriko duen energia quantum horren kopuru anizkoitza izango da beti. 1915ean Einsteinek, efektu fotoelektrikoa ikertzen ari zela, Plancken kuantizazioa irrada elektromagnetikoari aplikatu zion.
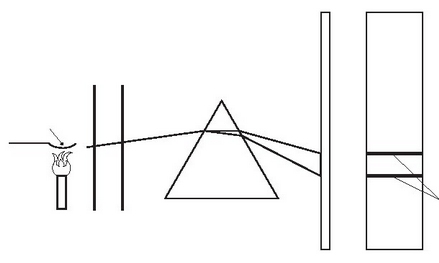
Espektroskopio baten eskema erraza.
Kuantizazioaren ideia horiek atomoari aplikaturik, Bohrrek proposatu zuen atomoa kuantizaturik zegoela, hots, energia kantitate jakin batzuk besterik ezin zituela izan. Elektroiak, beraz, ezin zuen edozein orbitatan biraka ibili gunearen inguruan, orbita jakin batzuetan baizik. Elektroiak, orbita horietan biraka ari dela ez du ener - giarik igorriko, baina orbita batetik bestera salto egiterakoan ener - gia xurgatu edo askatuko du. Horregatik ikusten dira espektroan kolore jakin batzuk (energia jakin batzuk).
Bohrren eredua hiru postulatutan oinarritzen da:
– Elektroia gunearen inguruan biraka ari da orbita zirkularretan energiarik igorri gabe.
– Elektroiak ezin du edozein orbitatan biraka ibili; baldintza matematiko jakin bat betetzen duten orbitetan ibiltzen da bakarrik.
– Energia handiagoko orbita batetik energia apalagoko beste batera elektroiak salto egiten duenean, energia fotoi moduan askatuko da.

Helioaren emisiozko (ezkerrean) eta absortziozko (ezkuinean) espektroak
Bohrren ereduak izugarrizko aurrerakuntza ekarri zuen atomoaren ezagueran, baina, hala ere, gaur egun ez da onartzen, gainditu egin da. Hidrogenoaren espektro zehatzagoak lortu zirenean, Bohrren ereduak ezin izan zuen hura guztia behar bezala esplikatu. Bestalde, Bohrren bigarren postulatu horrek hitzarmenez erabakia dirudi; zergatik baldintza matematiko hori, eta ez beste bat, bete?
Quantumen mekanika
1925-1927 urteetan Schrödinger (1887-1961), Heisenberg (1901-1976) eta Dirac (1902-1984), austriar, alemaniar eta britainiar fisikariek uhinen edo quantumen mekanika landu zuten. Mekanika horrek, Duc de Broglie (1892-1987) fisikari frantsesaren hipotesian eta Heisenbergen ziurgabetasunaren printzipioan oinarrituz, eta uhin ekuazioa deiturikoa aplikatuz, elektroia bezain txikiak diren partikulen portaera esplikatzen du. Schrödingerren uhin ekuazioa ebatziz gero, elektroiaren uhin funtzioa eta bere energia kalkulatzen dira. Uhin funtzio horren ebazpenean zenbaki jakin batzuk agertzen dira, quantum zenbakiak, hain zuzen. Energiaren adierazpenean zenbaki horiek ere azaltzen direnez, energia kuantizatuta dagoela garbi ikusten da. Beraz, energiaren kuantizazioa eta quantum zenbakiak ez dira datu esperimentalak esplikatzeko hitzarmenez onarturiko balioak, ekuazio matematiko baten ebazpenetik zuzenean lorturikoak baizik.
Teoria honen arabera uhin ekuazioa ebaztean, emaitzak ez du elektroiaren egongune eta lastertasun zehatza ematen mekanika klasikoan bezala. Uhin funtzioaren karratuak elektroia leku jakin batean aurkitzeko probabilitatea emango du bakarrik. Hauxe da uhin mekanikaren eta mekanika klasikoaren arteko bereiztasun nabarmenetako bat. Bohrren ereduan orbitak aipatu dira, elektroiak biraka aurkitzen diren lekua, alegia. Uhinen mekanika berrian, berriz, ezin da elektroia zehazki non dagoen esan; elektroia egoteko probabilitate handiena non dagoen esan daiteke, gehienez ere. Hori dela eta, nomenklatura pixka bat aldatu, eta orbitalez hitz egingo da hemendik aurrera. Atomo orbitala, beraz, elektroi bat aurkitzeko probabilitatea nabarmena duen nukleoaren inguruko eremua da.
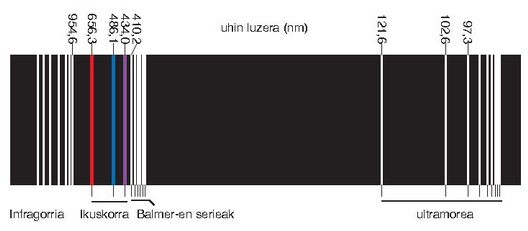
Hidrogeno atomikoaren (H) espektro osoa. Lerro ezberdinak taldetan biltzen dira eta serieak ematen dituzte.
Atomoen elektroi banaketa
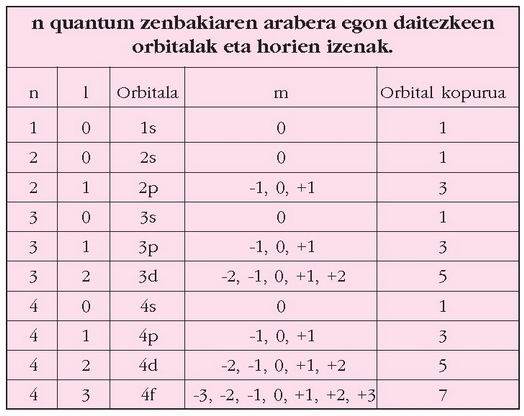
Atomoaren egitura azaldu denean, gunean protoiak eta neutroiak kokatu dira, eta elektroiak gunearen inguruan biraka. Elektroiak orbitaletan biraka ibiliko dira. Orbital desberdinetako elektroiek energia desberdina izan dezakete. Quantumen mekanikan proposatzen den ekuazioa –Schrödingerren ekuazioa– ebazterakoan, quantum zenbakiak azaltzen dira. Quantum zenbaki horiek n, l, m eta s letren bidez adierazten dira. Schrödingerren ekuazioaren ebazpenak quantum zenbaki horiek har ditzaketen balioak mugatzen ditu:

Orbitala, n, l eta m hirukotearen balio bakoitzak mugatuko dute; hau da, n=3, l=0 eta m=-2 balioek orbital jakin bat adierazten dute. Orbital horretan bi elektroirentzat dago lekua, bakoitzak s quantum zenbakiaren balio desberdina duela. Bi orbitalek n eta l berberak baldin badituzte, m-k ematen dituen aukeren arabera energia bereko orbitalak izango ditugu, hots, orbitalen energia n eta l quantum zenbakiek mugatuko dute. Orbitalak adierazteko zenbakibaten atzetik letra bat jartzen da. l=0, 1, 2, 3, 4 orbitalei s, p, d, f, g letra jarri zaie, eta aurretik n quantum zenbakiaren balioa ipintzen zaie. Adibidez, n=2 eta l=1 denean, orbital horri 2p esaten zaio, n=3 eta l=0 denean 3s, ….
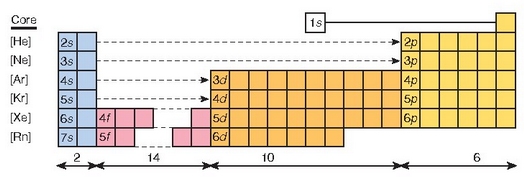
Elementuen taula periodikoaren eskema eta taularen talde eta periodo ezberdinetan zein orbital betetzen ari den.
l quantum zenbakiak energiaren balioarengan duen eragina n-k duena baino txikiagoa izanda ere, konbinazio bitxiak eman ditzake; esate baterako, sodio atomoaren 4s orbitalak energia apalagoa du 3d orbitalak baino. Elektroiak orbitaletan kokatzen hasten garenean energia apalenetik hasi eta energia altuenerako segida

Hodei elektronikoa eta nukleoa.
jarraitu beharko da; beraz jakin beharrekoa da zein den zehazki orbitalen energia. Orbital baten energia gero eta handiagoa da (n+l) batura gero eta handiagoa denean. Bi orbitalek batura berdina baldin badute energia gehiago izango du n handiena duenak. Arau hau zuzenean aplikatu beharrean, arau nemotekniko bat erabili ohi da. Honako eskema hau baliagarria izan daiteke. Geziek energia gorakorreko ordena adierazten dute.
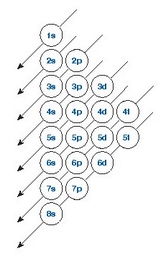
Atomo bat bere oinarrizko egoeran aurkitzen denean, orbitalak bata bestearen atzetik beteko dira elektroiez, energia apalenetik hasita. Beraz, atomo baten elektroi banaketa jakiteko, metodo hau jarraituko dugu:
1. Atomoak elektroirik ez duela onartuko dugu eta banakabanaka elektroiak orbitaletan ipintzen hasiko gara.
2. Elektroiak ahalik eta energia apaleneko orbitaletan jarri behar dira.
3. Energia berdineko orbitalak badaude, orbital bakoitzean elektroi bakarra jarri behar da.
4. Orbital bakoitzean gehienez bi elektroi sartuko dira.Adibidez, aluminioaren atomo zenbakia 13 da eta, beraz, 13 elektroi izango ditu. Era honetan banatuko dira elektroiak orbitaletan: bi elektroi 1s orbitalean, beste bi 2s orbitalean, sei 2p orbitalean, bi 3s orbitalean eta, azkenik, bat 3p orbitalean. Labur beharrez, era honetara adieraz daiteke elektroi banaketa hori:

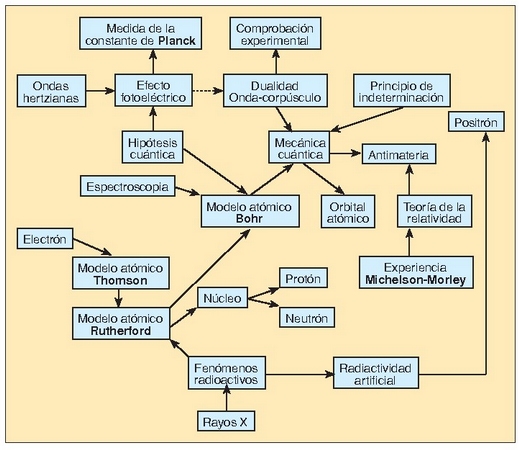
Historian zehar ezagututako hainbat fenomeno eta horien ondorioz garatutako teoria ezberdinak
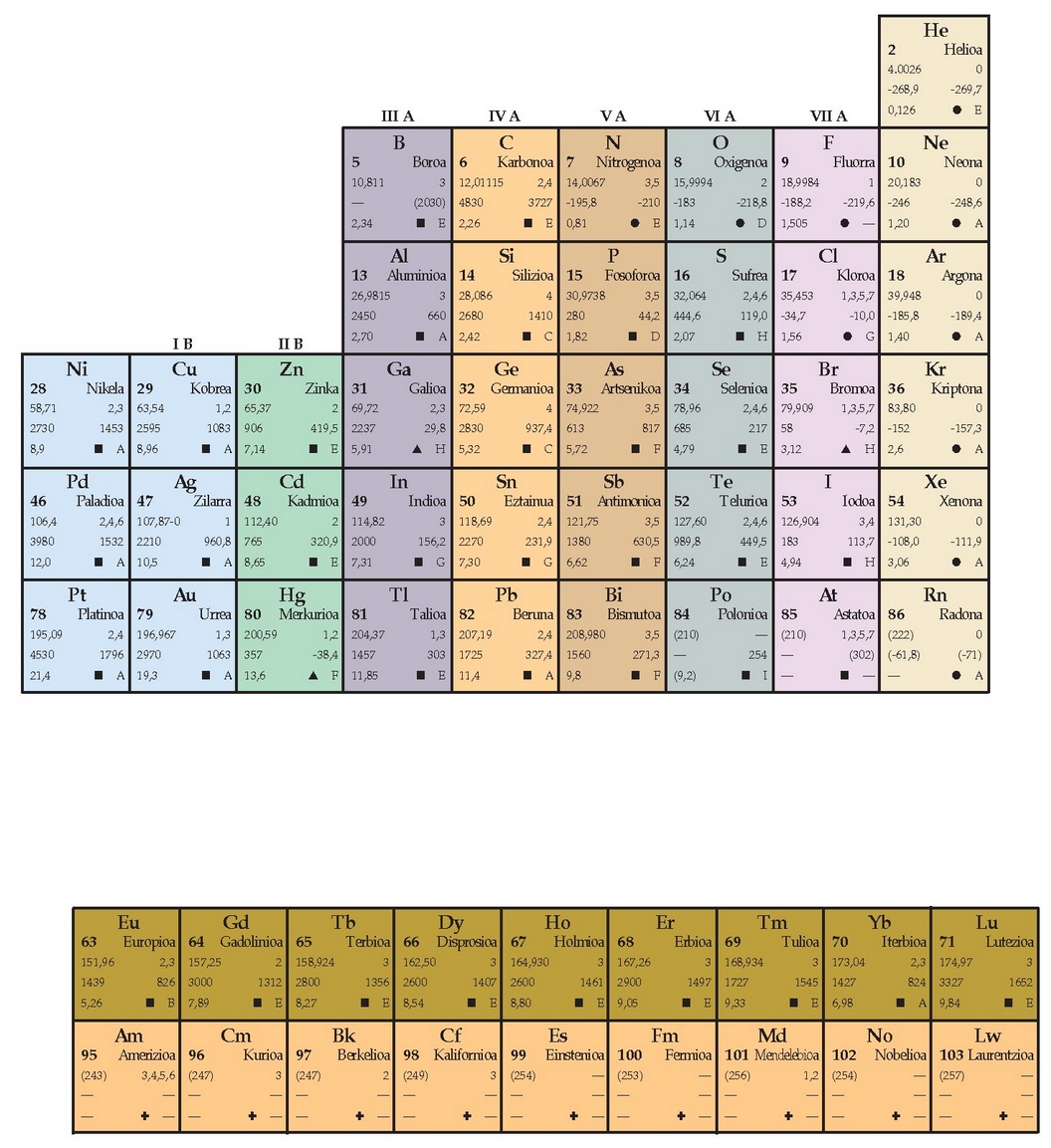
TAULA PERIODIKOA
Mendeleyeven sistema periodikoaXIX. mendean gero eta elementu gehiago ezagutu ziren eta elementu horien ezaugarri kimiko eta fisikoak pixkana-pixkana zehaztu ziren. Garai hartan saio ugari egin ziren elementu haiek nolabait bildu edo sailkatzeko. Hasieran lan bukaezina zirudien, datu eta tasun asko baitzegoen. 1829an Johann W. Döbereiner kimikari alemanarrak (1780-1849) ikusi zuen askotan agertzen zirela ezaugarri bertsuko hirukoteak, kloroa, bromoa eta iodoa, esate baterako, edo sufrea, selenioa eta teluroa, eta abar. Hirukotearen erdiko elementuaren pisu atomikoa beste bi elementuen pisuen batez besteko aritmetikoa zen. Errepikapen horien arrazoia aurkitu ez bazen ere, etengabe saiatu ziren horren arrazoia bilatzen.
1862an Alexandre Chancourtois kimikari frantsesak, pisu atomikoaren arabera sailkatu zituen elementuak bata bestearen atzetik, helize baten itxura zuen irudi bat osatuz. Bertikal berean tokatzen ziren elementuetan errepikapen bitxiak ikusi zituen. 1865ean John Newlands kimikari britainiarrak (1838-1898) irizpide beraren arabera ordenatu zituen elementuak, eta haien tasunak zortzinaka errepikatzen zirela ikusi zuen; hots, familia bereko elementuak ziren (errepikatze hori taulan gehiago aurreratuz gero, ez zela betetzen ikusi zuen). Elementuen tasunak zortzinaka errepikatze hori musika nota baten zortzidunarekin gertatzen denaren antzerakoa zela proposatu zuen. Bere garaian ez zitzaion garrantzirik eman proposamen hari. Lan horiek 1869an burutu ziren, Dimitri Mendeleyev kimikari errusirrak (1834-1907) lege periodikoa proposatu zuenean. Mendeleyeven berrikuntza nabarmenena ezagunak ziren elementuen artean hutsuneak uztea izan zen. Gainera, ohartu zen zenbait elementu gaizki zeudela zeuden taldean, eta zuten pisu atomikoa kontuan izan gabe sendikoen taldean ipini zituen. Bestalde, artean aurkitu ez ziren elementu batzuen tasun kimiko eta fisikoak iragarri zituen. Horregatik guztiagatik onartzen zaio Mendeleyevi taula periodikoaren aitatasuna. Berak ez zuen lehenbizi taula idatzi eta ondoren lege periodikoa proposatu; alderantziz, lege periodikoa proposatu zuen lehenbizi, eta ondoren taulara bihurtu zuen lege hori. Legea elementuen pisu atomikoaren arabera antolatu zuen, baina hala ere, zenbaitetan, ez zuen arazorik izan legea hautsi eta elementuak lekuz aldatzeko.
Taula periodikoaren historia
Stanislao Cannizzaro kimikari italiarra (1826-1910) izan zen taula periodikoaren (edo elementuen taularen) aitzindaria. 1858an, ordu arte ezagutzen ziren 60 elementuen pisu atomikoen zerrenda argitaratu zuen, eta elementuak pisu atomikoaren arabera ordenatzean, haien tasun edo propietate kimikoak modu bitxian errepikatzen zirela ikusi zuen harriturik. John Newlands kimikari ingelesa (1838- 1898) errepikatze bitxi horiez jabeturik, zortzikoteen legea aurkeztu zuen 1864an, baina barregarri geratu zen, nonbait. Handik bost urtera, Dimitri Ivanovitx Mendeleiev (1834-1907) kimikari errusiarrak gauza bertsua aurkitu zuen, baina harena aurrekoena baino aurkikuntza osoagoa izan zen, eta horrexegatik hartzen da bera taula periodikoaren sortzailetzat.
Mendeleievek, Kimikako hastapenak liburuan lanean ari zela (1869), elementuen izena eta horien tasun nagusiak banan-banan fitxetan jarri zituen, gero errezago ordenatu ahal izateko. Fitxa horiek ordenatzen ari zela, egungo taula periodikoaren eredua antolatu zuen. Mendeleievek pisu atomikoaren arabera ordenatu zituen fitxak, eta oxido berdintsuak ematen dituzten elementuak batera bildu zituen. Gero, zutabeetan antolatu zituen fitxak, eta orduz geroztik ezaguna den taula periodikoaren egitura eratu zuen.
Mendeleieven aurkikuntzarik garrantzizkoena, baina, ez zen izan
taula periodikoa antolatzea, elementuen artean ordena oinarriko
bat zegoela ohartzea baizik. Haren arabera, elementu batzuk faltaziren taulan, eta hutsarteak utzi zituen haientzat.
Mendeleiev, aurkikuntzaren zuzentasunaz konbentziturik, artean ezagutzen ez ziren elementuen tasunak aurrez esaten ere ausartu zen.
Adibidez, galioari (artean ezagutzen ez zela) ekoaluminio deitu zion, eta tasun hauek behar zituela proposatu zuen: «Pisu atomikoa 68;
oxidoaren forma, 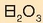 ; elementuak emango dituen gatzen formula,
; elementuak emango dituen gatzen formula,
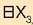 Galioa erredukzioz lortu ahal izango da, eta dentsitatea 5,9
izango du. Gai biguna izango da, eta fusio tenperatura apala izango
du. Airean ez da oxidatuko; gorituta, ura deskonposatuko du...
Oxidoaren dentsitatea, 5,5 inguru izango da. Azido sendoetan disolbatuko
da. Uretan hidrato amorfo disolbaezina osatuko du, eta
azidoetan eta alkalietan disolbatuko da.... Beharbada, analisi espektroskopikoen
bidez aurkitu ahal izango da, Indioa eta Titanioa
aurkitu ziren bezala». Eta halaxe gertatu zen, gertatu ere. 1875ean,
analisi espektroskopikoa erabiliz, galioa aurkitu zen, eta Mendeleievek
iragarritako tasun guztiak bete ziren.
Galioa erredukzioz lortu ahal izango da, eta dentsitatea 5,9
izango du. Gai biguna izango da, eta fusio tenperatura apala izango
du. Airean ez da oxidatuko; gorituta, ura deskonposatuko du...
Oxidoaren dentsitatea, 5,5 inguru izango da. Azido sendoetan disolbatuko
da. Uretan hidrato amorfo disolbaezina osatuko du, eta
azidoetan eta alkalietan disolbatuko da.... Beharbada, analisi espektroskopikoen
bidez aurkitu ahal izango da, Indioa eta Titanioa
aurkitu ziren bezala». Eta halaxe gertatu zen, gertatu ere. 1875ean,
analisi espektroskopikoa erabiliz, galioa aurkitu zen, eta Mendeleievek
iragarritako tasun guztiak bete ziren.
Elementuen taula proposatzean, Mendeleievek lekuz aldatu zituen zenbait elementu pisu atomikoen ordena trukatuz, elementu jakin bat bere «kideekin» batera zutabe berdinean ager zedin. Bitxikeria hori isotopoak ezagutu zirenean argitu ahal izan zen.
1869az gero beste 40 elementu gehiago aurkitu, edo erreakzioz lortu dira, eta taula periodikoa berriz diseinatu da elementu berri horiei lekua uzteko. Mendeleievek elektroiaren aurkikuntzaren berri izan zuen, baina ez zen elektroiak nukleoaren inguruan nola dauden banatuta ezagutzera iritsi, alegia, bere taula periodikoaren oinarria ezagutzera iritsi.
Elementuen taula edo sailkapen periodikoa
Atomoetan elektroiak eta protoiak daudela jakin baino askoz ere lehenago, kimikariak elementu ezagunen tasunak neurtzen eta elementu horien arteko erlazioak bilatzen saiatu ziren.
Elementuak era ordenatu batean sailkatzen saiatu ziren, eta taula periodikoa (edo substantzia sipleen taula) osatu zuten azkenean. Taula periodikoak informazio baliotsua biltzen du kimikari batentzat. Periodikoa esaten zaio zenbait tasun erregulartasunez edo maiztasun jakin batez errepikatzen direlako. Gaur egun ezaguna da taula horren funtsezko oinarria atomoen elektroi banaketa dela.
Taula periodikoaren antolamendua
Taula periodikoan goitik beherako eta ezkerretik eskuinerako ilarak bereizten dira. Goitik beherakoak taldeak dira eta besteak, berriz, periodoak. Talde bateko elementuen tasun kimikoak eta fisikoak antzekoak dira, hau da, familia bereko elementuak dirudite. Talde baten barruan, tasunek aldaketa erregularrak agertzen dituzte elementu batetik bestera aldatzean. Periodo batean, aldiz,ez da antzekotasunik elementuen tasunen artean; aitzitik, alde handiak daude.
Taula periodikoaren barruan antzeko tasunak dituzten elementuen artean azpimultzoak bereiz daitezke, hala nola, ez-metalak (taularen eskuinaldean), metalak (ezkerraldean), trantsizioko metalak edo trantsizio elementuak (erdialdean) eta barne trantsizioko metalak (taulatik kanpo agertu ohi dira, taula gehiegi zabaldu ez dadin).
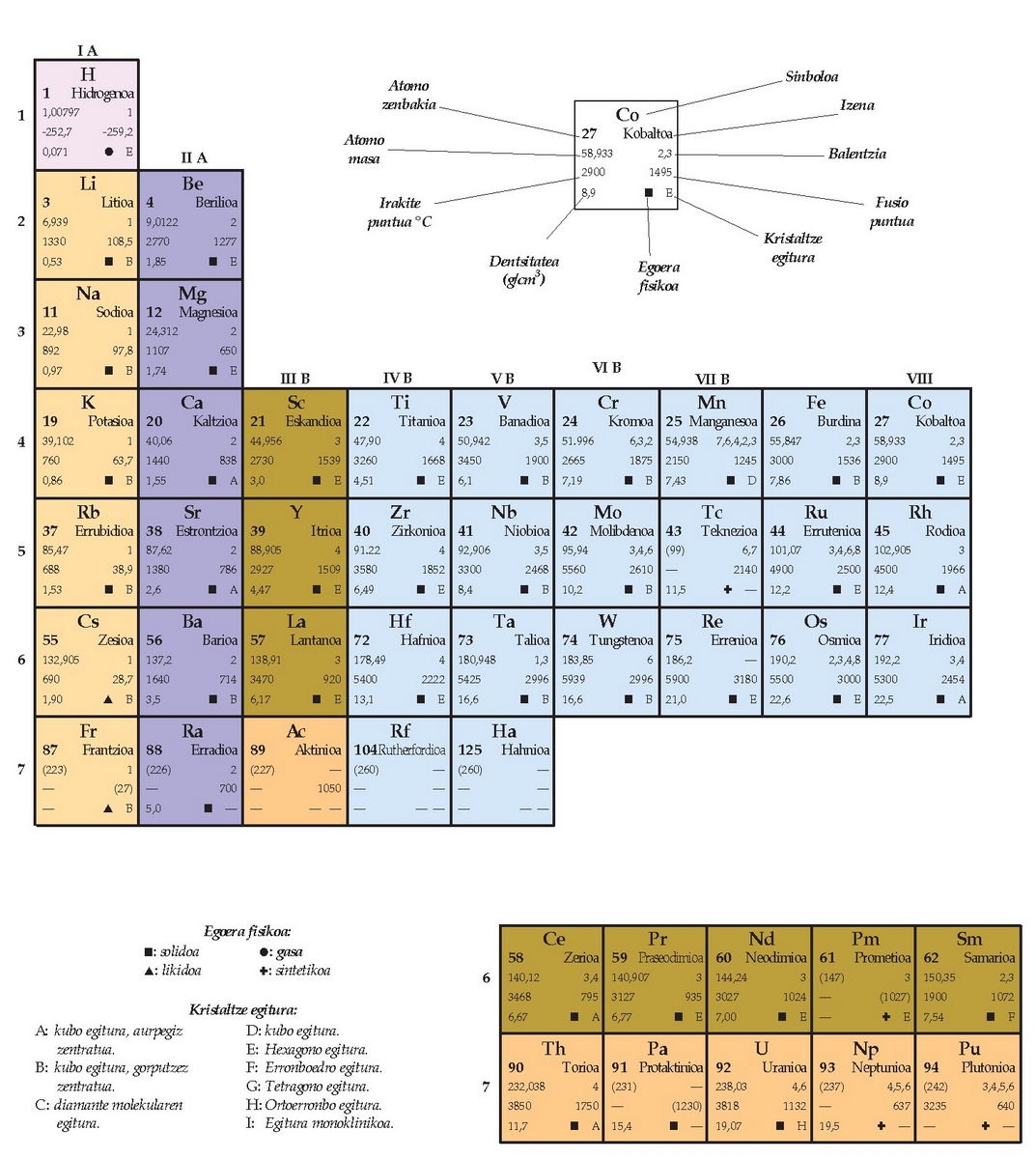
Elektroien banaketa aztertzean s, p, d eta f orbitalak aipatu dira; gehienez ere, 2, 6, 10 eta 14 elektroi sartzen dira, hurrenez hurren, orbital horietan. Horrexegatik, s orbitala betetzen ari direnek (metal alkalinoak eta alkalino lurtarrak) osatzen dituzte taularen lehenengo bi taldeak. Taulako lehenengo taldea azkenengo s orbitalean elektroi bakarra duten elementuek osatzen dute (Li, Na, K, Rb, Cs eta Fr), alegia, metal alkalinoek. Bigarren taldea, berriz, azkeneko s orbitalean 2 elektroi dutenek (Be, Mg, Ca, Sr, Ba, Ra), metal alkalino-lurtarrek. Taularen beste aldetik hasiz gero, ordea, p orbitala betetzen ari diren elementuak daude: 6 talde, beraz.
Azkeneko taldeak beterik dauka bere azken elektroi geruza;
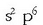 egitura dute,
beraz, talde horretako gaiek, eta gas noble edo geldo esaten zaie (Ne, Ar, Kr, Xe eta Rn).
Horren aurreko taldeeko elementuei, berriz, elektroi bat falta zaie
egitura dute,
beraz, talde horretako gaiek, eta gas noble edo geldo esaten zaie (Ne, Ar, Kr, Xe eta Rn).
Horren aurreko taldeeko elementuei, berriz, elektroi bat falta zaie
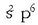 egitura lortzeko
(F, Cl, Br, I eta At); halogenoak dira. Talde horren aurrekoei 2 elektroi falta zaizkie
egitura lortzeko
(F, Cl, Br, I eta At); halogenoak dira. Talde horren aurrekoei 2 elektroi falta zaizkie
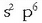 egitura lortzeko,
eta horren aurrekoei 3, etab. Esan bezala, taularen erdialdeko 10 taldeak trantsizioko metalak dira,
eta elementu horietan d orbitala betetzen ari dira. Barne trantsizioko metalak dira azkenak; betetzen ari dira f orbitala,
eta hori dela eta, 14 talde agertzen dira.
egitura lortzeko,
eta horren aurrekoei 3, etab. Esan bezala, taularen erdialdeko 10 taldeak trantsizioko metalak dira,
eta elementu horietan d orbitala betetzen ari dira. Barne trantsizioko metalak dira azkenak; betetzen ari dira f orbitala,
eta hori dela eta, 14 talde agertzen dira.