Izadi Jakintza»Izadi jakintza
Proteinak
LABURPENA: Izaki bizidunetan biomolekula organiko ugarienak protidoak edo
proteinak dira. Proteinak aminoazidoz osatuak dira. Aminoazido horietatik hogei ia
proteina guztietan izaten dira. Aminoazidoak lotura peptidikoen bidez lotzen zaizkio
elkarri, eta lotura horietatik aminoazido kateak sortzen dira; katea horiek, luzeraren
arabera, bi eratakoak izan daitezke: peptidikoak edo proteinikoak.Proteinak edo protidoak biomolekula
organikoak dira, karbonoz (C), hidrogenoz
(H), oxigenoz (O) eta nitrogenoz (N)
osatuak; gai horiez gainera, sufrea (S) eta,
gutxiagotan, fosforoa (P), burdina (Fe),
kobrea (Cu), magnesioa (Mg) eta beste bioelementu
batzuk izaten dituzte. Izena “protos”
(lehena) hitz grekotik datorkie, izan ere,
izaki bizien osagai nagusitzat hartzen baitira:
izakien pisu lehorraren %50-80 bitarte hartzen
dute.
Proteinen osaera kimikoa nahikoa
iraunkorra da; oinarrizko banako multzo
baten (aminoazidoak) errepikapenetik
abiatuta osatu diren molekula handiak
(polimeroak edo makromolekulak) direla
esan daiteke.
Aminoazidoak
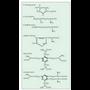
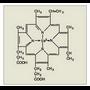
Proteinak osatzen dituzten molekula organikoak dira aminoazidoak. Talde amino bat (-NH 2 ) eta talde azido bat (-COOH) izaten dute beti; hortik datorkie izena (1.
irudia). Azken mendeetan gai asko aurkitu dira aminoazidoaren definizioarekin bat datozenak, baina proteinetan 20 mota besterik ez dira aurkitu; mota horiek, gainera, izaki bizidun guztietan errepikatzen dira.
Aminoazidoak ugariak dira izadian; hautemateko sistema berriei esker, izar arteko eremuan ere aurkitu dira. Unibertsoan bizitza gertaera arrunta denaren ustea sendotzen du aurkikuntza horrek.
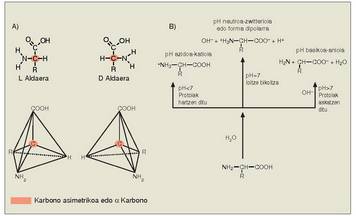
Aminoazidoek, glizinak salbu, karbono asimetriko bat izaten dute. Karbono hori amino eta azido taldeari lotzen zaie (a karbono esaten zaio). Karbono horri esker aminoazidoak bi osaera izan ditzakete, bi isomero optikoak edo enantiomeroak sortzen dituztenak. Isomero horiek argi polarizatua eskuinerantz (+) edo ezkerrerantz (-) okertzen dute. Enantiomeroak batzuk besteen ispilu dira, hau da, molekula biratuta ere, ezinezkoa da molekularen bi formak batzea. Amino taldea eskuinean duenazidoek katioi bezala funtzionatzen dute,
eta pH basikoetan anioi bezala. pH ia neurtroan
aminoazidoek polo biko ioien antzeko
portaera dute; horregatik, karga deusezten
da. Aminoazido mota bakoitzaren
neutrotasun puntuari puntu isoelektriko
esaten zaio.
Aminoazido molekula mota ugari aurkitu
dira, eta saio asko egin dira horiek sailkatzeko;
saio horien guztien artetik gehien erabiltzen
dena erroak (R) kontuan hartzen
dituen sailkapena da, hau da, kontuan hartzen
duena a karbonoaren azpitik “buztana”
osatzen duen molekula zatia. R taldearen
arabera aminoazido mota hauek bereizten
dira:
– Aminoazido hidrofoboak. R erroak ezin
dituenez ioi hidratatuak osatu, ezin nahas
daiteke urarekin. Hauek dira aminoazido
hidrofoboak: alanina, leuzina, isoleuzina,
balina, prolina, metionina, fenilalanina eta
triptofanoa.– Kargarik gabeko aminoazido polarrak.
Aminoazido hidrofoboak baino errazago
urtzen dira uretan. Erroetan atomo multzo
batzuk dituzte, karga “errealik” izan ez
arren, polarrak direnak, elektroiak talde
bereko atomo batetik hurbilago dituztelako.
Hala gertatzen da esate baterako alkoholetan,
-SH-n eta aminoetan. Horren ondorioz,
“karga birtualak” sortzen dira eta horiei
esker elkartzen dira ur molekulak eta atomo
multzo horiek (3. irudia).
Kargarik gabeko aminoazido polarrak
hauek dira: glizina, serina, treonina, tirosina,
zisteina, asparragina eta glutamina.
– Aminoazido azidoak. Aminoazido mota
horiek bi talde azido dituzte (-COOH).
Bigarren talde azidoa, lehena bezala, ur disoluzioan
ioitzen da, eta horrek, karga negatiboa
nagusitzea eragiten du (talde azidoen bi
karga negatibo, talde aminoaren karga positibo
baten aurrean). Hauek dira aminoazido
azidoak: azido aspartikoa eta azido glutamikoa.Azido glutamikoaren gatza, glutamato
izenaz ezaguna, asko erabiltzen da elikagai
industrian, janarien ahogozoa indartzeko.
– Aminoazido basikoak. Talde amino bat
baino gehiago izaten dute (-NH , edo -
3
NH), beraz, disoluzioan karga positiboak
96nagusi dira negatiboen aurrean. Lisina, arginina
eta histidina azido basikoak dira.
Aminoazido mota horiez gainera, bada
beste aminoazido multzo bat proteinetan
ohikoa ez dena, baina oso ugaria dena proteina
molekula mota jakin batzuetan (animalien
zuntz proteinetan) eta zenbait organismotan
(zenbait landaretan). Dena dela,
aminoazido guztiak aipatu diren lau aminoazido
talde horien eratorriak dira (4. irudia).Baina bada beste aminoazido talde bat
organismoetan ohikoak diren 150 aminoazidoez
osatua. Aminoazido horiek ohikoak
badira ere, ez dira inoiz proteinetan agertzen.
Garrantzi handiko funtzioak betetzen
dituzte izaki bizidunen metabolismoan.
Zitrulinak eta ornitinak adibidez, bitartekari
lana egiten dute ohiko aminoazidoen sintesian.
Beste gai batzuk, berriz, kanabina esaterako,
gai toxikoak dira, eta landareek berez
sortzen dituzte. Kanabina hatxisaren printzipio
eragilea da, eta Indiako kalamutik ateratzen
da (marihuana). Aminoazido talde
horren barruan daude D aldaera duten aminoazidoak,
organismo jakin batzuetan (landareetan
eta onddoetan batez ere) besterik
izaten ez direnak. D-alanina esaterako, intsektu
askoren larbetan eta krisalidetan izaten
da; D-serina oligoketoetako proteinetan
(lur zizarea) izaten da, eta azido D-glutamikoa,
berriz, bakterien zelula paretetako proteinetan.– Heteroproteinak :
Aminoazido kateak
Aminoazidoak elkartzen direnean peptidoak eta proteinak sortzen dira. Peptidoak eta proteinak bereizteko aminoazido kopurua hartzen da kontuan: 100 aminoazidotik behera dituenean peptidoa da, eta 100dik gora dituenean proteina.
Hala ere, gai elkartu horietako bat sortzeko, edozein motakoa dela ere, ezinbestekoa da aminoazidoak elkarri lotzea. Lotura hori lotura berezi baten bidez gertatzen da, lotura peptidikoaren bitartez hain zuzen. Aminoazido baten talde aminoa beste aminoazido baten talde azidoarekin elkartzen denean gertatzen da lotura peptidikoa. Lotura horretan ur molekula bat galtzen da (6. irudia).Lotura peptidikoak protidoetan eratzen
dira bakarrik, eta horregatik, protidoak aurkitzeko
erabiltzen dira (Biureten froga) (II.
taula).
Lotura peptidikoa laburra izaten da; lotura
horretatik sortzen diren molekulak, beraz,
zurrunak dira, loturan parte hartzen duten
atomo guztiek plano berean egon behar baitute.
Lotura peptidikotik sortzen diren proteinek
eta peptidoek mutur batean amino talde
bat dute eta bestean azido talde bat; beraz,
gai berri horiek ere ioi bipolarrak osatzeko
ahalmena izango dute. Hala ere, ioi bipolarrak
osatzeko ahalmen hori ez da aminoazidoetan
bezain nabarmena, izan ere, aminoazido
katea oso batek banatzen baititu aminoeta azido taldeak. Ondorioz, kateek sistema
leungarri baten antzeko portaera dute: H +
ematen edo hartzen dute inguruneko pHaren
arabera.Ezaugarri optikoak ere badituzte. Katea laburraren jarduera optikoa aminoazido bakoitzak zeinek bere aldetik duten jardueren batuketa da. Hala ere, proteinetan eta peptido handietan, jarduera optikoa molekulek espazioan duten kokaeraren araberakoa da, eta ez proteinak osatzen dituzten aminoazidoen jarduera optikoaren araberakoa.
Peptidoak
Izadian dauden peptido gehienak proteinen hausturatik sortuak dira (hidrolisia).
Hala ere, badira zenbait peptido proteinen osagai ez direnak: peptido ez proteiko esaten zaie (7. irudia).
Peptidoek, oro har, aminoazido ez proteikoak dituzte, eta horregatik, proteinek ez bezalako egitura dute. Aminoazido horien zeregina da peptidoak proteinak endekatzeko zeregina duten entzimen erasoetatik babestea, proteasetatik babestea, alegia.
Peptido ez proteikoek izaten dituzte: batetik, zenbait gai hormonaren lana egiten dutenak (basopresina, oxitozina eta TSH) eta bestetik, zenbait antibiotiko (gramizidina eta balinomizina).
Beste zenbait peptidok, glutatioiak esaterako, era askotako funtzioak betetzen dituzte: lipidoak autooxidaziotik babestea, edo zenbait entzima aktibatzea. Bradikinina izerdiarekin batera eta listu guruinen bidez jariatzen den peptidoa da; hodi dilatatzaile garrantzitsua da, eta gai hau jariatzen duten guneetara odol kopuru handiagoa eramanarazten du, eta izerdia eta listua jariatzea eragiten du. Karnosina gihar zuntzetako peptidoa da.
Proteinak
Proteinen ezaugarri nagusietako bat aldakortasuna da, bai osakerari dagokionez, bai formari dagokionez.
+ Proteinen egitura mailak Proteinen egitura mailaren bidez proteina molekulek espazioan duten konplexutasuna azaltzen da. Oro har, lau egitura maila bereizten dira: * Lehen mailako egitura. Lotura peptidiko bidez sortutako aminoazidoen sekuentziari dagokio (8. irudia).Lehen mailako egituran bi alderdi bereizten
dira: amino taldea duen alderdia batetik
(amaierako N), eta azido taldea duena bestetik
(amaierako C). Sekuentzia idazten denean,
sekuentziaren hasieran amierako N
muturra jartzen da beti.
Lehen mailako egitura arrosario baten
modukoa da, parte batzuk gogorrak ditu eta
beste batzuk, berriz, malguak. Alderdi gogorrak
lotura peptidikoan parte hartzen duten
atomoak dira; atomo horiek nahitaez plano
berean egon behar dute. Aminoazidoaren
gainerako parteak, aldiz, hainbat lekutanegon daitezke; parte horiek osatzen dute
alderdi malgua.
Lehen mailako egitura mota ugari dago,
izan ere, sekuentziako aminoazido bat aldatzea
nahikoa baita lehen mailako egitura
berri bat osatzeko. Proteinek espezifikotasun
handia dute; horregatik, animalia mota
desberdinen arteko espezifikotasunaz gainera,
izaki desberdinen artekoa ere bada.
Organismo batek, birlandatzen zaizkion
organoak onar ditzan, kontuan hartu behar
da proteinen espezifikotasuna.
Aminoazidoen sekuentzian alderdi batzuk
aldakorrak dira eta besteak egonkorrak,
horregatik dago hainbeste egitura mota.
Proteinek ezinbestekoak dituzte alderdi
egonkorrak beren funtzioak betetzeko;
beraz, alderdi horiek banako batetik bestera
ez dira aldatzen, ezta animalia mota ahaideen
artean ere. Alderdi aldakorrek, berriz, ez
dute eraginik proteinaren funtzioetan,
alderdi egonkorrari “eusten” dioten betegarriak
direla esan daiteke; beraz, desberdinak
dira animalia mota ahaideetan, baita mota
bereko banakoen artean ere.
* Bigarren mailako egitura. Proteinak
espazioan era (egitura) berezian jartzen dira,
metabolismo prozesuetan bete behar dituzten
funtzioetara ahalik eta ondoen egokitzeko
moduan. Aldez gogorra den lehen mailako
egitura batetik abiatuta, nola iristen da
bigarren mailako egiturara? a karbonoaren
lotura kobalenteak duen biratzeko gaitasunari
esker gertatzen da hori. Horrez gainera,
lotura peptidikoaren planoan dauden oxigeno
eta hidrogeno atomoek hidrogenozko
zubi motako lotura ahulak osatzeko duten
joera ere bigarren mailako egitura osatzeko
lagungarri da. Lotura horiek egitura tolestua
orekatzen laguntzen dute.Arrazoibide horren arabera, gerta daiteke
forma askotako proteina naturalak osatzea
maila horretan; hala ere, proteina gehienek
hiru forma hauetako bat hartzen dute:
+ * a helizea. Aminoazido kateak helize
itxura izaten du, erlojuaren orratzen norabidean.
Bira batean batez-beste 3,6 aminoazido
dago, eta R erroak espiralaren kanpoalderantz
daude “zintzilik”. Beraz, lotura
peptidikoek (atomoak dagokien planoan
bilduta dituztela) eta a karbonoak eskailera
horren “eskutokia” osatzen dute. Lehen mailako
egituraren zurruntasunak malgukia
“aska” ez dezan, lotura peptidiko guztien
planoetako oxigenoek eta hidrogenoek
zubiak eraikitzen dituzte kiribilaren gainetik
edo azpitik dauden beste oxigenoekin eta
hidrogenoekin (lotura peptidikoaren beste
planoetara lotuta) (10. irudia).Proteinek forma hori hartu ala ez, proteinak
osatzen dituzten aminoazidoen mende
dago (III. kuadroa). Aminoazido hidrofoboetan
eta kargarik gabeko polarretan uxatze
arazo gutxi izaten da kontrako kargen artean;
bestalde, aminoazido mota horiek egiturari
bere horretan mantentzen laguntzen diote.
Horrez gainera, aminoazido mota horien
artetik, R erro txikiena dutenek (a karbonoari
lotuta dagoen aminoazido molekularen
zatiari esaten zaio erro) helizetik “zintzilik”
dagoen materian desoreka arazo gutxi eragiten
dituzte eta helizeari bere horretan irauten
laguntzen diote. Aminoazido ziklikoek arazo
asko sortzen dituzte, prolinek esaterako, izan
ere, lotura peptidiko bat den guztietan birarazten
baitituzte kateak.
Aminoazido arruntek a helizearen oreka
gordetzeko betetzen duten zeregina. Dena
dela, arrunta ez den aminoazido bat azaltzen
da, hidroxiprolina, proteinetan eragiten
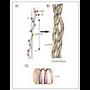
dituen gorabeherak aztertzeko.+ * Kolagenozko helizea. Antolamendu
berezia da erabat. Prolina eta hidroxiprolina
(ziklikoak) ugari duten aminoazido
sekuentziek (kolagenoa) berezkoa dute egitura
hori. Hiru aminoazido besterik ez dute
izaten birako. Espiralak, bestalde, ezkerrerantz
biratzen du. Katearen barruan, hidrogeno
zubiek egitura orekatzen dute, a helizean
gertatzen den bezala. Hiru birako
multzoak elkarri lortzen zaizkio bi leuzinaz
osatutako kobalenteen bidez (espiral bakoitzeko
leuzina bat). Hiru multzo lotzen direnean
deshidrolisinonorleuzina sortzen da
(11. irudia).
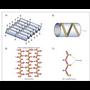
*ß egitura edo xafla tolestua. R erro txikiko
aminoazido ugari dituzten proteinek izaten
dute egitura mota hori. Helizearen bira
bakoitzean bi aminoazido besterik ez dago
(hau da, sigi-sagan). Egitura orekan egondadin hainbat molekula elkartzen dira plano
berean; hala, hidrogenozko zubiak osatzen
dira katea desberdinetako lotura peptidikoaren
planoan dauden hidrogeno eta oxigeno
atomoen artean. R multzoak xaflaren planotik
gora eta behera gelditzen dira. Zenbaitetan,
kateak era antiparaleloan izaten dira,
hau da, amaierako N eta amierako C muturrak
txandakatu egiten dira katea batetik
bestera (12. irudia).
Proteina mota horietako batzuk hauskorrak
dira, eta beste batzuk, berriz, hedakorrak.
Batzuek besteetatik R erroak desberdintzen
ditu: erroak zenbat eta txikiagoak
izan, orduan eta txikiagoa da elkarren arteko
loturak osatzeko eta xafla tolestuaren
egitura osatzeko aukera. Esate baterako,
sedaren osagai nagusiak glizina eta alanina
dira (-H eta -CH
3
erroak, hurrenez hurren);
osagai horiek egiturari eusten diote eta
hedakor bihurtzen dute. Ezaugarri biokimiko
hori dela eta, sedazko jantziak ez dira
99zimurtzen eta ondo egokitzen dira gorputzera.
Horregatik da antzinatik hain preziatua
seda, eta horrexegatik beragatik, sortu
zen “sedaren bide” ospetsua, Txinatik seda
inportatu ahal izateko, Txina baitzen seda
egiteko formula zuen munduko leku bakarra.
Hala ere, bide hartatik sedaz gainera
beste hainbat tresna eta ideologia inportatu
ziren, mendebaleko gizartean iraultza sortu
zutenak (papera, bolbora, eta uste denez,
inprimaketa).
Egitura hori, bestalde, a helizearekin txandaka
daiteke proteina berean; halakoetan,
egituraren tolesaren edo “ukondoen” parean
egokituko litzateke xafla tolestua.
* Hirugarren mailako egitura. Proteinek
ez diote bigarren mailako egiturari bere
horretan eusten; bere gain tolestu eta hirugarren
mailako egitura sortzen dute. Egitura
horren oreka, bestalde, disulfuro zubien
bidez gertatzen da. Disulfuro zubiak sufrea
duten aminoazidoen bidez (metioninaz eta
zisteinaz, adibidez) osatzen dira (13. irudia).
Lotura ahulak ere izaten dira egitura horretan:
hidrogenoaren zubia, Van der Waalsen
indarrak, lotura hidrofobikoak edo ioi
lotura ahulak adibidez.
Proteinek hirugarren mailako bi egitura
mota izaten dituzte:
+* Egitura izpitsua. Bigarren mailako egitura
pixka bat deformatzen denean sortzen
da egitura izpitsua.
Egitura mota hori dute kolagenozko helizeek
edo a helizea duten proteinek: bigarren
mailako bi egitura baino gehiago lotu etaespiral edo superhelize berri bat osatzen
dutenean (14. irudia).Xafla tolestuaren motako proteinetan ere
osatzen da egitura hori, plano desberdineko
xaflak elkartzen direnean. Azkazalak esaterako,
etxe bateko teilen antzera, elkarren gainka
jarrita dauden proteina geruzek osatzen
dute.
Egitura orekatzen duten loturak hainbat
motakoak izan daitezke: disulfuro motakoak,
katea desberdinen arteko hidrogeno
zubiak, edo aminoazido espezifikoen arteko
lotura kobalenteak (ikus kolagenozko helizea).
Egitura hori duten proteinak ez dira uretan
solbagarri, ez baitira dispertsio koloidalak
osatzera iristen (saia zaitez ilea edo
lumak disolbatzen, ezta berotuta ere!). Proteina
horiek egiturazko funtzioa dute organismoan.
+* Globulu formako egitura. Egitura
mota horretan bigarren mailako egitura erabat
deformatzen da, ia esfera izatera iristeraino.
Tolesturak izateko, proteinek a helize
motako bigarren mailako egitura dute zati
zuzenetan eta xafla tolestuaren egitura
ukondoetan (15. irudia).
Egituraren oreka aminoazidoen R erroen
arteko lotura ahulek mantentzen dute batez
ere.
Mota horretako proteinek dispertsio
koloidalak osatzen dituzte uretan edo gatzsoluzioetan. Organismoan funtzionalak
dira, eta entzimen, hormonen edo garraiatzaileen
funtzioak betetzen dituzte.* Laugarren mailako egiturak. Egitura hori
osatzeko elkarri lotuta egon behar dute hirugarren
mailako egitura duten zenbait katea
polipeptidikok. Proteina mota horiei proteina
oligomeriko esaten zaie, eta proteina horretako
katea bakoitzari protomero (azpibanako
edo oligomero ere esaten zaio). Proteina bi
protomeroz osatuta badago, dimero esaten
zaio, hiruz osatuta badago trimero, lauz badago
tetramero, eta horrela hurrenez hurren.
Azpibanako askok osatzen dutenean proteina
polimeroa dela esaten da (16. irudia).
Protomeroak lotura ahulen bidez elkartzen
dira.
Proteinen egiturarekin zerikusi zuzena
duen ezaugarria desnaturalizazioa da, hau
da, berezko egituraren galera, edo beste erabatera esanda, formaren galera (goi mailako
egitura mailak) berezko osakera aldatu gabe
(lehen mailako egitura).Proteina baten ingurunearen baldintzak
aldatzen direnean gertatzen da desnaturalizazioa,
pH-a edo tenperatura aldatzen denean
adibidez.
Jogurta, mamia edo gazta egitean adibidez,
pH-aren aldaketaren bidezko desnaturalizazioa
gertatzen da. Hiru kasu horietan
esnea garrazten da gatzagiaren, gai artifizialen
edo bakterien bidez, eta ondorioz, dispertsio
koloidalean zeuden proteinak hauspeatzen
dira.
Beroaren ondoriozko desnaturalizaioaren
adibide argia arrautza frijituan gertatzen da:
zuringoan den proteina (albumina) gel izatetik
gai gotor zuri izatera aldatzen da. Haragiaren
gihar zuntzetako proteinetan beroaren
bidezko desnaturalizazioa gertatuko ez
balitz, esaterako, haragiak nazka emango
liguke, hala ere, bada jendea haragia gordinik
jaten duena.+ Proteinen sailkapena
Proteinak osakeraren arabera sailkatzen
dira. Aminoazidoez bakarrik osatuta dauden
proteinak holoproteinak dira. Proteinaren
molekulan aminoazido ez diren gai
zatiak badaude (edozein dela ere horien osakera
kimikoa), heteroproteina esaten zaie.
Proteinaren barruan zati proteiko bat edo
talde proteikoa, eta zati ez proteikoa edo
talde prostetikoa bereizten dira.
Sailkapen zehatzagoa egin nahi izanez
gero, holoproteinak egituraren arabera sailkatzen
dira, heteroproteinak, aldiz, duten
talde protetikoaren arabera sailkatzen dira
(IV. taula).
Biologian garrantzi handien duten proteinak
Atal honetan behin eta berriro aipatu da proteinaren molekulak era askotakoak izan daitezkeela; horrexegatik, ezinezkoa da proteina mota guztien artetik zati txiki bat bera ere aipatzea. Dena dela, bada proteina talde bat biologian duen garrantziagatik gainerakoetatik nabarmentzen dena (gizakietan batez ere):
Holoproteina izpitsuak.
+ Kolagenoak. Bigarren mailako egitura kolagenozko helizearen motakoa dute.
Hirugarren mailako egitura, berriz, bigarren mailako zenbait egitura kiribiltzean superhelize bat osatzen denean eratzen da.
Kolagenoak ehun konektiboetan izaten dira, eta zelula arteko gaia osatzen dute.
Zenbat eta handiagoa eta astunagoa izan animalia, orduan eta handiagoa da proteinetako kolageno zatia. Horrek zerikusi handia du proteinek betetzen dituzten eusteko funtzio mekanikoekin.Kolagenoa argi ikus daiteke haragiz eta
hezur puskez egindako salda bat hozten
denean: kolagenoa gai trinko bihurtzen da
eta gelatina osatzen du.
+ Keratinak. Bigarren mailako egituraren
arabera bi keratina mota bereizten dira: a-
keratinak (a helizea) eta ß-keratinak (xafla
tolestua).
a-keratinek zisteina aminoazidoa (sufreduna)
dute. Ilea, azkazalak, apoak, adarrak
eta lumak proteina mota horrek osatuak
dira. Gai horiei guztiei, erretzen direnean,
kiratsa darie, zisteina deuseztean sulfuro
lurrinak sortzen baitira. Zisteina kopuruak
eta aminoazido horretatik abiatuta sortzen
diren disulfuro zubiek bereizten dute proteina
mota bat besteetatik. Proteina gogorrenak
(adarrak eta apoak) aminoazido mota
horren %22 edukitzera iristen dira, hedakorrenek
(ilea eta azaleko zenbait geruza),
berriz, %10-14 besterik ez dute.
Mota horretako keratinak bero hezeaz
berotzean luzatzen dira. Esate baterako, tenperaturaeta hezetasun aldaketekin ilea uzkurtu eta luzatu egiten da, eta berezko luzera bikoiztera iristen da. Ezaugarri horretaz baliatzen ziren garai batean higrometroak eta termometroak egiteko (1. argazkia).
b-keratinek ez dute zisteinarik; erro txikiko aminoazido asko dituzte (alanina edo glizina).
Beroarekin ez dira ez luzatzen ez uzkurtzen eta oso malguak dira. Sedan, ezkatetan, zenbait animaliaren atzapar muturrean eta hegaztien mokoan izaten dira.
Holoproteina globularrak
+ Histonak. Aminoazido basiko eta txiki ugari dituzte, beste proteina moten aldean.
Zelula eukariotoen ADN-an izaten dira.
+ Albuminak. Erraz osatzen dituzte dispertsio koloidalak. Hornigaia gordetzeko zeregina izan ohi dute. Era horretako proteinak arrautzetan, esnean edo odolean izaten dira.
+ Globulinak. Dispertsio koloidala eratzen dute gatz disoluzioetan, eta zenbaitek baita uretan ere. Entzima asko globulinak dira.
Heteroproteinak :
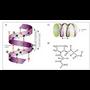
+ Hemoglobina. Talde prostetikoari hemo taldea esaten zaio. Talde hori burdina duen eraztun tetrapirrolikoaz (porfirina ere deitua) osatuta dago (17. irudia).
Laugarren mailako egitura du hemoglobinak; a motako bi kateez (141 aminoazido) eta b motako bi kateez (146 aminoazido) osatutako tetrameroa da. Lau hemo talde ditu, eta lotura ahulen bidez daude elkarri lotuta.
Egitura mota horretan, hemo taldeko burdina oso bizkor lotzen da oxigenoarekin, baita oxigeno gutxi dagoenean ere.
+ Mioglobina. Hemoglobinaren oso antzekoa da: batetik, betetzen duen funtzioagatik (oxigenoaren garraioa) eta, bestetik, hemoglobulinak duen hemo taldearen berdina duelako. Hala ere, katea txiki bakar batez osatutako proteina da (153 aminoazido) (18. irudia).+ Glukoproteinak. Glukoproteinaren
talde prostetikoak gluzido molekulak ditu.
Talde horren barruan daude hormonak
(FSH eta LH) eta muki jarioetako zenbait
gai lodi (mukoproteinak), sinobia isurkariak
eta odoleko zenbait proteina. Proteina
talde honetan sartzen dira inmunitatean
parte hartzen duten antigorputzak edo
inmunoglobulinak.
+ Lipoproteinak. Kasu honetan talde
prostetikoa azido gantz batek edo fosfolipido
batek osatzen du. Lipoproteinak zelularen
mintza osatzen du eta odoleko lipidoak
garraiatzen ditu. Multzo honetakoak dira
odolean kolesterola garraiatzen duten proteinen
lau aldagaiak (VLDL, LDL, IDL eta
HDL). Aldagai horiek zerikusia dute kolesterolarekin
harremana duten eritasunekin.
+ Fosfoproteinak. Talde prostetikoa azido
ortofosforikoa da (H
3
PO
4
). Esnearen kaseinan
eta arrautzaren gorringoan izaten da.