Fisika-Kimika»Fisika - Kimika
Formulazio ez-organikoa
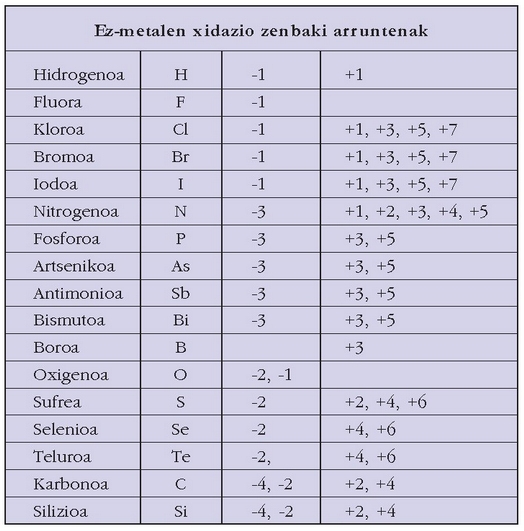
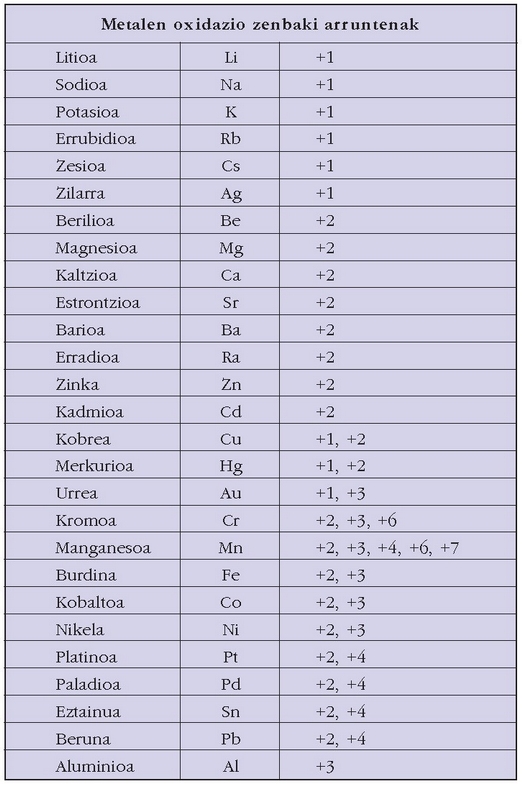
Nahiz elementu kimikoak asko ez izan (guztira 100 inguru baldin badira ere, batzuk ez dira apenas agertzen), hauen konbinazioz lortutako substantzia kimiko asko dago. Horrexegatik substantzia guztiak identifikatu eta sailkatzeko metodo bat ezarri zen. Kimikariek elementu bakoitzari ikur bat egokitu diote (aluminioa, Al; sodioa, Na; urrea, Au…) eta sustantzia bakoitza identifikatzeko sustantzia zein elementuez eta elementu bakoitzaren zein proportzioz osatuta dagoen adierazten duten formulak erabiltzen dituzte:
adibidez, azido sulfurikoa: 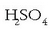
Elementu berak isotopo bat baino gehiago izan ditzake, baina isotopo guztiak ikur berdinaz adierazi behar dira (onartutako salbuespen bakarra hidrogenoarena da: hidrogenoa, deuterioa eta titrioa).
Formula motei dagokienez, hiru hauek bereizten dira:
– formula enpirikoa: substantziaren osaera adierazteko bere gaien proportzioa soilik agertzen denean, adibidez sodio kloruroa adierazteko NaCl formula erabiltzen denean. Formula horrek ez du esan nahi sodiozko atomo batez eta klorozko beste batez osaturiko molekula esistitzen denik, baizik eta sodio kloruroan sodio eta kloro atomoak konbinatzen direla, bietatik kopuru bera.
– molekula formula: sustantzia osatzen duten gaien proportzioaz gainera, sustantziaren molekulan agertzen
diren gaien kopuru errealak agertzen direnean. Adibidez, ur oxigenatua edo hidrogeno peroxidoa:
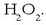 .
.
– egitura formula: ez bakarrik elementuak eta hauen proportzioak, espazioan hartzen duten antolamendua ere agertzen denean.
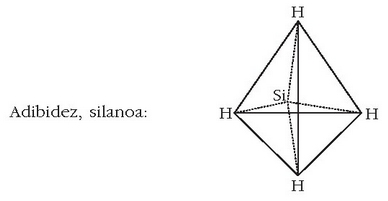
Formulak idazterakoan elementuen ordena erabakitzeko elektronegatibotasun taula hau hartzen da oinarri:
B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I, Br, Cl, O, F
Hidrogenoaren konposatu bitarrak
Hidrogenoaren konposatuei hidruro esaten zaie. Hidrogenoaren elektronegatibotasuna bitartekoa denez, bai metalekin, bai ez-metalekinelkartzen da eta eratzen ditu konposatuak. Metal tipikoekin jokaera elektronegatiboa du eta H -ioia sortzen du (metalak, aldiz, katioi positiboa sortuko du). Hidrogenoa elkartzen den metalaren balentzia zein den, hidrogeno bat, bi edo gehiago agertuko dira konposatuan. Adibidez:

Ez-metalekin konbinatzen denean, batzuen aurrean elektropositiboa izango da, eta beste batzuen aurrean, aldiz, elektronegatiboa. Adibidez:

VI eta VII taldeetako elementuekin eratzen dituen sustantziek disoluzio azidoak ematen dituzte uretan disolbatutakoan, eta izen hau ematen zaie (ur disoluziotan):

V eta VI taldeetako hidruro batzuk izen bereziak hartzen dituzte, eta hitzarmenez onartuak:

Oxidoak
Oxigenoa beste elementu batekin (izan metal, izan ez-metal) elkartzen denean sortzen diren gaiak dira oxidoak. Fluorra izan ezik, gainerako elementuak oxigenoa baino elektropositiboagoak direnez, elementua idatziko da aurretik eta oxigenoa ondoren. Oxigenoaren balentziarik arruntena -2 da.
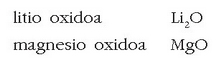
Baina badira balentzia bat baino gehiagorekin agertuko diren elementuak. Kasu hauetan elementua zein balentziarekin ari den zehaztu beharko da:
a) aurrizkien bidez elementuen proportzioa adieraziz:

b) elementuaren ondoren bere balentzia zenbaki erromatarrez parentesien artean adieraziz:
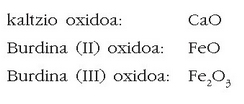
Peroxidoak
Konposatu hauetan peroxido ioia 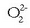 agertzen da. Ezagunena ur
oxigenatua da. Adibidez:
agertzen da. Ezagunena ur
oxigenatua da. Adibidez:
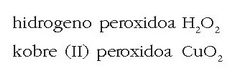
Metal/ez-metalez osaturiko gai elkartu bitarrak
Aurretik elementu metalikoa ipiniko da (bera baita elektropositiboena) eta elementu ez-metalikoari -uro atzizkia erantsiko zaio:

Ez-metalez osaturiko gai elkartu bitarrak
Gai elkartu hauek aurreko atalean azaldu bezala izendatzen dira, kontuan izan behar da zein gai jarri behar den eskuinean eta zein ezkerrean; gai elektronegatiboena jartzen da ezkerrean eta horri erantsiko zaio -uro atzizkia.

Hidroxidoak
Hiru gaiz osatuak dira: gai metaliko bat, oxigenoa eta hidrogenoa. Guztietan hidroxido ioia agertzen da (OH - ) eta elementu metalikoaren balentziak adierazten du formulan zenbat aldiz agertuko den OH - ioia formulan. Hidroxido hitza erabiltzen da gai elkartua izendatzeko.

Azidoak: oxiazidoak
Kimikaren alorrean azido izaera azaltzeko teoria bat baino gehiago eman dira (Bronsted-Lowry-ren azidoa, Lewis-en azidoa). Atal honetan azaltzen direnak betidanik azido gisa hartuak izan badira ere, badira substantzia batzuk «azido» izenaz izendatzen ez direnak nahiz izaera azidoa izan.
Sail honetan aipagarria da, besteak beste, azido sulfurikoa: H2 SO4. IUPAC-ek proposatutako izendatze moduaren arabera honela izendatu beharko litzateke:
hidrogeno tetraoxosulfato(VI).
Baina atal honetako substantzien ohiko izenak oso ezagunak dira eta kasurik gehienetan lehengo izendatze metodoa jarraitzen da. Oxiazidoak izendatzeko azido hitzaren ondoren elementu ez-metalikoaren erroa jartzen da eta horri atzizkia eransten zaio, elementuaren balentzia zein den adierazteko. Elementu horrek bi balentzia bakarrik baldin baditu, txikiena erabiltzen denean -oso atzizkia jartzen da eta handiena denean -iko. Baina elementuak bi balentzia baino gehiago dituenean txikienari hipo- aurrizkia eta oso atzizkia ipintzen zaio, hurrengoari -oso atzizkia, hurrengoari -iko atzizkia eta azkenari -per aurrizkia eta -iko atzizkia. Adibidez:

Ez-metalak balentzia bakarra duenean -iko atzizkia erabiliko da, adibidez:
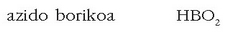
Formula aurkitzeko bide bat hauxe izan daiteke: dagokion balentziarekin ez-metal horren oxidoa lortu eta ondoren ur molekula bat gehitu. Adibidez:

Badaude oxiazidoen artean ur molekula bat baino gehiago onar - tzen dutenak, nagusiki, fosforoa, silizioa, teluroa… Kasu honetan zenbat molekula ur hartu dituen adierazteko meta-, piro- eta ortoaurrizkiak erabiltzen dira (1, 2 edo 3 molekula ur):
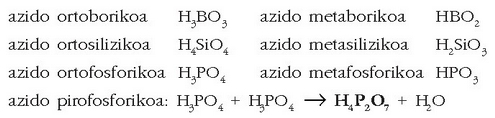
Hauen artean batzuk arruntagoak direnez besteak baino, batzuetan aurrizkia kentzen da eta asmatu egin behar
izaten da zein den ordezkatzen duen ezkutuko atzizkia. Adibidez azido fosforiko esaten denean azido ortofosforiko esan nahi da:
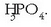
Tioazidoak
Formula osatzeko azido hauek oxiazido batean oxigenoaren ordez sufrea ordezkatuz lortu direla esan daiteke. Adibidez:

Gatzak
Gatzei dagokien atalean oxiazidoetatik eratorritako gatzak izango dira aztergai. Orain arte aztertutako gatzak (metal/ez-metalez osaturiko gai elkartu bitarrak) ez dira hemen sartuko, nahiz denak gatzak izan.
Oxiazidoetatik eratorritako gatzak izendatzeko dagokien oxiazidoa formulatu ondoren (honek ez du esan nahi azido hori esistituko denik) hidrogeno atomo guztiak edo batzuk elementu metaliko batekin ordezkatuko dira. Ordezkapen hau egiterakoan oxiazidotik datorren anioiaren balentzia kontuan hartu behar da eta orobat elementu metalikoarena. Azido hitza kendu eta atzizkiak zertxobait aldatuko dira: -oso atzizkiaren ordez -ito, eta -iko atzizkiaren ordez -ato. Adibidez:

Hidrogeno guztiak ordezkatzen ez direnean gatz azidoak lortzendira. Kasu honetan zenbat hidrogeno gelditzen diren adierazi behar da. Adibidez:

Azken sustantzia eta haren antzeko beste batzuk sodio bikarbonato izenaz ezagutzen dira.