Fisika-Kimika»Fisika - Kimika
Metalak
Metal adierazkorrak
Atal honetan metal adierazkorren azterketa egingo da, hau da, beren kanpo orbitaletan s
edo p orbitalak betetzen dituzten metalenak. Lehenik s orbitalean elektroi bakarra dutenak
aztertuko dira: metal alkalinoak hain zuzen ere. Hidrogenoak metal alkalinoen egitura
elektroniko bera du 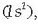 ,
eta metala izan ez arren, elementu hau
aztertuko da lehenik
,
eta metala izan ez arren, elementu hau
aztertuko da lehenik
Hidrogenoa
Hidrogenoak (H) hiru isotopo ditu, baina isotopo ugariena nukleoan protoi bakarra duena da
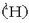 ; gainerako biak deuterioa
(
; gainerako biak deuterioa
( 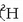 edo D) eta tritioa
edo D) eta tritioa
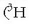 edo T) dira. Deuterioak neutroi
bat eta protoi bat ditu nukleoan, eta tritioak protoiaz gainera bi neutroi ditu. Hidrogeno guztiaren
%0,02 deuterio isotopoa da, beraz, hidrogenozko 10.000 atomoen artean bi bakarrik izango dira deuterio atomoak.
Deuterioaren nukleoan neutroia egoteak isotopo honen masa bikoizten du (hidrogenoarenari buruz); beste isotopoetan,
aldiz, ez da horrelako masa-aldaketa nabarmenik gertatzen. Hori dela eta, erreakzio batean hidrogenoaren ibilbidea aztertu
nahi baldin bada, hidrogenoan deuteriozko atomoen proportzioa handitzen da eta horrela masa espektrometriaren bidez azter
daiteke hidrogenoaren ibilbidea.
edo T) dira. Deuterioak neutroi
bat eta protoi bat ditu nukleoan, eta tritioak protoiaz gainera bi neutroi ditu. Hidrogeno guztiaren
%0,02 deuterio isotopoa da, beraz, hidrogenozko 10.000 atomoen artean bi bakarrik izango dira deuterio atomoak.
Deuterioaren nukleoan neutroia egoteak isotopo honen masa bikoizten du (hidrogenoarenari buruz); beste isotopoetan,
aldiz, ez da horrelako masa-aldaketa nabarmenik gertatzen. Hori dela eta, erreakzio batean hidrogenoaren ibilbidea aztertu
nahi baldin bada, hidrogenoan deuteriozko atomoen proportzioa handitzen da eta horrela masa espektrometriaren bidez azter
daiteke hidrogenoaren ibilbidea.
Hidrogenoa unibertsoko gairik ugariena baldin bada ere, oso hidrogeno gutxi dago
lurrean aske, hidrogenozko molekulak 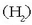 oso arinak izanik, oso laster mugitzen baitira eta eguratsetik ihes egiten baitute. Izarren ingurunea hidrogenozko
atomo sakabanatuez osaturik dago; izarretan ere osagai nagusia hidrogenoa da, eta eguratsaren kanpoko geruza ere
hidrogenozko atomoez osaturik dago.
oso arinak izanik, oso laster mugitzen baitira eta eguratsetik ihes egiten baitute. Izarren ingurunea hidrogenozko
atomo sakabanatuez osaturik dago; izarretan ere osagai nagusia hidrogenoa da, eta eguratsaren kanpoko geruza ere
hidrogenozko atomoez osaturik dago.
Hidrogenoa gas bat da, kolorgea, zaporegabea eta usaingabea, eta
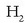 molekula diatomikoz osaturik dago.
Uretan ia disolbaezina da eta 20 K-tan isurkari edo likido kolorge baten moduan kondentsatzen da.
molekula diatomikoz osaturik dago.
Uretan ia disolbaezina da eta 20 K-tan isurkari edo likido kolorge baten moduan kondentsatzen da.
Hidrogenoa oso substantzia erabilia da, Estatu Batuetan adibidez urtean 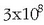 kg hidrogeno erabiltzen dira, besteak beste espaziountzietako erregai gisa (%1 bakarrik). Industrian erabiltzen den hidrogenoaren erdia
Haber prozesuan erabiltzen da (amoniakoaren sintesian). Beste erabilera garrantzitsu bat metanolaren sintesia da:
kg hidrogeno erabiltzen dira, besteak beste espaziountzietako erregai gisa (%1 bakarrik). Industrian erabiltzen den hidrogenoaren erdia
Haber prozesuan erabiltzen da (amoniakoaren sintesian). Beste erabilera garrantzitsu bat metanolaren sintesia da:

Erreakzio hau 300° C inguruan eta 250 atm-ko
presioan gertatzen da, katalizatzaile gisa zink, kromo, manganeso eta aluminiozko oxidoak erabiltzen direla.
Metanola formaldehidoaren (HCHO) sintesian erabiltzen da (eta berau plastikoen sintesian) eta azido azetikoaren
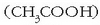 sintesian (azido azetikoa zuntz sintetikoen
sintesian erabiltzen da).
sintesian (azido azetikoa zuntz sintetikoen
sintesian erabiltzen da).
Kobrearen erauzketa hidrometalurgikoan ere erabiltzen da:
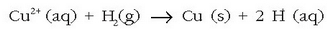
Orotara gastatzen den hidrogenoaren herena gutxi gorabehera erredukzio hidrometalurgikoetan erabiltzen da.
Elikagaien industrian ere erabiltzen da hidrogenoa, landare olioak hidrogenatzeko. Karbono-karbono lotura bikoitzak hidrogenazioz apurtu eta lotura sinple bihurtzen direnez, olioaren katea malguagoa bihurtzen da eta kateen arteko lotura sendoagoa denez egoera fisikoa ere aldatzen da (hasieran isurkari zena, gotor bihurtuko da).
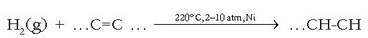
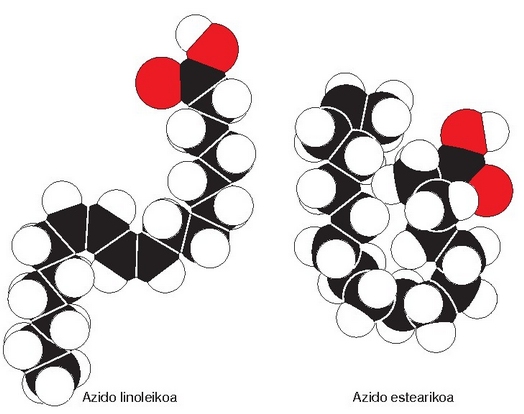
Azido organikoen kate malguak. Gorriz azidoen funtzio taldea agertzen da: -COOH
Gizarte modernoak behar duen hidrogeno kantitatea izadian dagoena baino handiagoa denez, industrian erabiltzen den hidrogeno gehiena pisu molekular txikiko hidrokarburoetatik lortzen da. Erreakzio hau bi alditan gertatzen da:
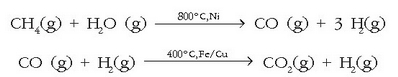
Industrian ur lurrina ikatzean (kokean) zehar pasarazten da 1000° C-tan:
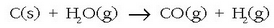
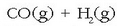 nahasteari «ur gasa» esaten zaio eta erregai gisa erabiltzen da.
nahasteari «ur gasa» esaten zaio eta erregai gisa erabiltzen da.
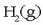 purua behar denean, CO(g)-tik bereizteko urrina eransten
zaio nahasteari eta 500° C-tan dagoen katalizatzaile
batean zehar pasarazten da:
purua behar denean, CO(g)-tik bereizteko urrina eransten
zaio nahasteari eta 500° C-tan dagoen katalizatzaile
batean zehar pasarazten da:
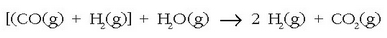
Ondoren anhidrido karbonikoak
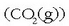 uretan duen disolbagarritasun handia aprobetxatuz hidrogenotik
uretan duen disolbagarritasun handia aprobetxatuz hidrogenotik
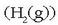 bereizten da.
bereizten da.
Hidrogenoa lortzeko beste metodo bat uraren elektrolisia da, baina metodo hau elektrizitatea merkea den lekuetan bakarrik da errentagarria. Gaur egun, kimikarien helburuetako bat ura fotokimikaren bidez deskonposatzea da:
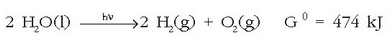
Deskonposaketa hori ez da berez gertatuko, baina argiak energia nahikoa ematen baldin badio lor daiteke erreakzio hori eskuinerako norantzan gertatzea. Orain arteko arazo nagusia erreakzio hori bideratzeko katalizatzaile egokia aurkitzea izan da.
Laboratorioan hidrogenoa lortzeko metodorik erabilienak erredox erreakzioak dira, adibidez:
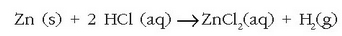
edo
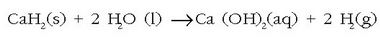
Bigarren erreakzioa puxikak betetzeko hidrogeno iturri gisa erabiltzen da.


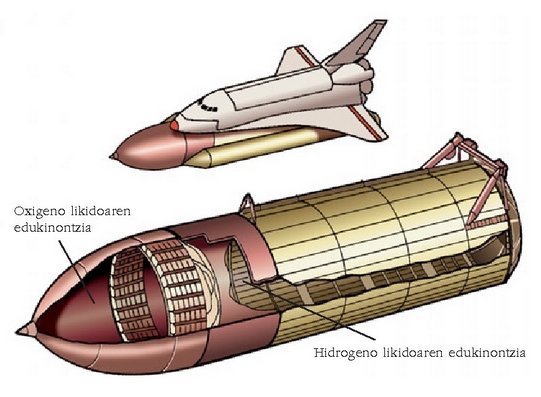
Espazio untzi bateko erregaien edukinontziak. Hidrogenoarena askoz ere handiagoa da oxigenoarena baino, oso dentsitate txikia baitauka
Hidrogeno isurkariaren ezaugarri nabarmenetako bat bere dentsitate apala da,
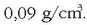 . Dentsitate hori dela eta, hidrogenoa gordetzeko erabiltzen
den espazi ontzietako biltegiak oso handia izan behar du.
. Dentsitate hori dela eta, hidrogenoa gordetzeko erabiltzen
den espazi ontzietako biltegiak oso handia izan behar du.
Hidrogenozko molekulen artean indar edo hidrogenozko zubi bereziak eratzen dira. Zubi horiek hainbat gaitan agertzen dira, eta ezaugarri bereziak ematen dizkiete izadiko zenbait gairi, adibidez, lurrin presio txikia ematen diete urari edo amoniako edo hidrogeno fluoruroari. Gainera hidrogenozko zubiak direla-eta ur gotorra (izotza) isurkari bihurtzen denean, tenperatura apaletan (0-4° C) ur isurkariak dentsitate handiagoa dauka ur gotorrak baino, eta horrexegatik izotzak uretan igeri egiten du (pentsa zer gertatuko litzatekeen iceberg-ekin horrela izango ez balitz).
Hidrogenoaren garrantziaren beste arrazoietako bat bere katioiaren tamaina txikia da, H + -aren tamaina (protoia) hain zuzen;
hidrogeno neutroaren diametroaren 10.000rena da. Tamaina txikia dela eta, indar handiz erakartzen ditu elektroiak,
Lewis azido sendo baten moduan 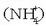 edo
edo
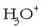 ioiak oso erraz sortzen dira).
Kasu askotan, hidrogeno atomoa oxigenoari, halogeno atomo bati edo nitrogeno positiboari
ioiak oso erraz sortzen dira).
Kasu askotan, hidrogeno atomoa oxigenoari, halogeno atomo bati edo nitrogeno positiboari
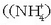 -ren kasuan bezala) lotuta dagoenean protoi
moduan askatu eta beste molekula batera lekualdatu daiteke. Horren ondorioz Brönsted-Lowry azido moduan jokatzen du.
-ren kasuan bezala) lotuta dagoenean protoi
moduan askatu eta beste molekula batera lekualdatu daiteke. Horren ondorioz Brönsted-Lowry azido moduan jokatzen du.
Hidrogenoa konposatu askotan agertzen da, baina beste elementuak aztertzean ikusiko dira gai horietako gehienak. Hidrogenoaren konposatu tipiko gisa hidruro bitarrak izango dira aztergai.
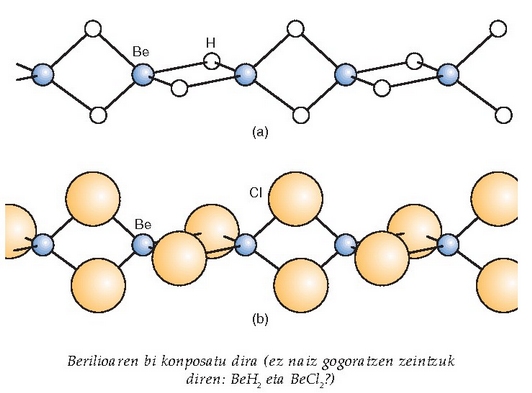
Hidruroak hidrogenoa metal alkalinoekin eta alkalino lurtarrekin konbinatzean sortzen dira (berilioa izan ezik).
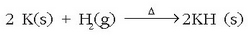
Konposatu hauek gai gotor zuriak dira, fusio puntu altua dute eta beren kristal egitura haluro metalikoen antzekoa da (NaCl etab.). Eta ura erreduzitzeko ahalmena dute:
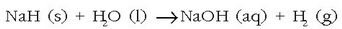
Erreakzio hau dela eta, hidruro metalikoek gas hidrogenoa lortzeko aukera ematen dute.
Hidrogenoaren beste konposatu garrantzitsu batzuk hidrogenoa elementu ez-metal
batekin erreakzionatzean lortzen dira, adibidez amoniakoa 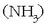 ,
metanoa
,
metanoa 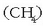 , etilenoa
, etilenoa
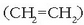 , ura
, ura
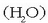 ...
...
Produktu hauek lortzeko hidrogenoa zuzenean erreakzionarazten da ez-metalarekin:
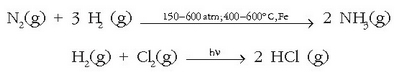
Eta azkenik, trantsizio metalekin sortutako hidruroak daude. Hidruro hauek d taldeko metalak hidrogenoarekin berotuz lortzen dira:
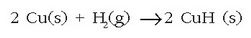
Metal alkalinoak
Metal alkalino esaten zaie I taldeko gaiei. Beren elektroi banaketan azken geruzan
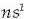 konfigurazioa dute eta honek
ematen dizkie ezaugarri bereizgarri gehienak.
konfigurazioa dute eta honek
ematen dizkie ezaugarri bereizgarri gehienak.
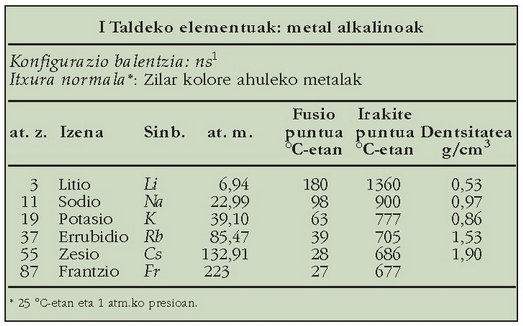
Metal hauek ez dira izadian aske agertzen oso erraz oxidatzen baitira; konposatuen osagai moduan agertu ohi dira. Metal askeak euren gatz fundituetatik lortzen dira elektrolisi bidez. Lurrazalean ugarienak sodioa (%2,6) eta potasioa (%2,4) dira, gainerakoak oso arraroak dira. Frantzioak berak isotopo bakarra du, erradiaktiboa, eta oso bizitza laburra du. Potasioak eta zesioak ere isotopo erradiaktiboak dituzte.
Litioa izan ezik, gainerako guztiak metal bigun, urraerraza eta zilar itxurakoak dira. Litioa gogorragoa da. Zesioa urre kolorekoa da eta erreaz urtzen da, gizakiak eskuetan hartuz adibidez. Metal hauen banaketa elektronikoa dela eta, bero eta elektrizitatearen eroale onak dira eta efektu fotoelektrikoa jasaten dute, hau da, argia iristen zaienean elektroia askatzen dute; hori dela-eta, zelula fotoelektrikoetan erabiltzeko oso egokiak dira.
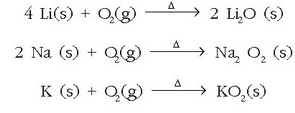
Metal alkalinoek zenbait erreakziotan parte hartzen dute. Urarekin adibidez erredox erreakzioa bideratzen dute:
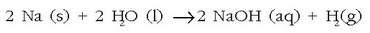
Erreakzio hau indartsuagoa da metal alkalinoen taldean taulan behera egin ahala: litioak erraz erreakzionatzen du, sodioaren kasuan erreketa gerta daiteke eta potasioa, rubidioa eta zesioaren kasuan erreakzioa oso lasterra eta bortitza denez, leherketa gerta daiteke.
Erreakzioan zehar askatutako energiak hidrogenoarentzako sugarra eman dezake. Rubidio eta zesioaren kasuan arriskua oraindik nabarmenagoa da; izan ere, ura baino dentsitate handiagoa dute eta ontziaren hondora joango direnez, erreakzioa urpean gertatuko da eta erreakzioan sortutako hidrogenoak gorantz ihes egitean uhin bortitza sortu eta ontzia txiki-txiki eginda utz dezake.
Elementu ez metalikoekin ere ematen dituzte erreakzioak. Nitrogenoarekin erreakzionatzen duen bakarra litioa da:
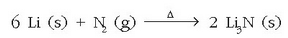
Metal alkalino guztiek ez dute berdin erreakzionatzen oxigenoarekin. Katioi txikienek anioi txikiekin
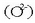 erreakzionatzen dute, eta katioi handienek anioi
handiagoekin (peroxidoak
erreakzionatzen dute, eta katioi handienek anioi
handiagoekin (peroxidoak 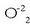 , superoxidoak
, superoxidoak
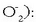
Potasio superoxidoa adibidez 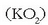 leku itxietako airea hobetzeko erabili ohi da,
anhidrido karbonikoarekin erreakzionatzen baitu:
leku itxietako airea hobetzeko erabili ohi da,
anhidrido karbonikoarekin erreakzionatzen baitu:
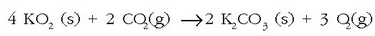
Horren antzeko erreakzioa ematen dute gainerako peroxidoek ere
(sodioarenak edo litioarenak adibidez). Litio peroxidoaren kasuanabantaila bat badu, bere masa molekularra dexente txikiagoa denez
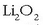 masa txikiagoak aire kantitate berdina garbituko du;
horrexegatik erabili ohi da espazio ontzietan.
masa txikiagoak aire kantitate berdina garbituko du;
horrexegatik erabili ohi da espazio ontzietan.
Metal alkalinoen eta beren gaien aplikazio ezagunenak hauek dira:
- Litioaren konposatuak baterietan (piletan), zeramiketan eta labaingarrietan erabiltzen dira. Medikuntzan litio karbonato moduan erabiltzen da depresio maniatikoak sendatzeko (bere eraginkortasunaren zergatia oraindik ez da argitu). Litioa, sodioaren antzera, erreaktore nuklearretan erabiltzen da beroa trukatzeko, bero ahalmen handieneko elementua baita.
- Sodioaren konposatuak ezagunagoak dira: sodio kloruroa, sodio hidroxidoa, sodio sulfatoa edo sodio karbonatoa. Oro har, sodio kloruro gehiago erabiltzen da azido sulfurikoa baino; meatzetatik zuzenean edo lurrinketaz lortzen da. Sodio kloruroaren elektrolisiaz kloroa eta sodio hidroxidoa lortzen dira (sosa kaustiko izenaz ere ezaguna):
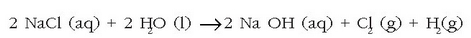
NaOH konposatua zenbait
erabileratarako ekoizten da: rayona lortzeko; garbikariak, ehuna, xaboia, papera egiteko,…; sodio sulfatoa
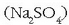 kartoizko kaxak egiteko, papergintzan eta fosfatoen ordezko gai gisa;
sodio nitratoa
kartoizko kaxak egiteko, papergintzan eta fosfatoen ordezko gai gisa;
sodio nitratoa 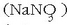 ongarriak egiteko; sodio karbonatoa
ongarriak egiteko; sodio karbonatoa
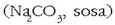 beiraren 2 3 industrian, berotutakoan sodio oxidoa ematen baitu…
Mende honen hasieratik sodio karbonatoa Solvay prozesua jarraituz lortzen bazen ere, 1940. urte inguruan Estatu Batuetako Wyoming
estatuan lurpeko biltegi handia aurkitu zen eta garraio kostuak handiak ez badira behintzat, askoz ere merkeagoa da Solvay prozesua baino.
beiraren 2 3 industrian, berotutakoan sodio oxidoa ematen baitu…
Mende honen hasieratik sodio karbonatoa Solvay prozesua jarraituz lortzen bazen ere, 1940. urte inguruan Estatu Batuetako Wyoming
estatuan lurpeko biltegi handia aurkitu zen eta garraio kostuak handiak ez badira behintzat, askoz ere merkeagoa da Solvay prozesua baino.
- Potasiozko gatzak oso garrantzitsuak dira bizitzarako. Potasio nitratoa 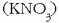 ongarri bikoitz moduan erabiltzen da (N eta
K). Leherkarietan ere erabiltzen da. Baina oso gauza gutxitarako
da espezifikoa, eta horregatik sodioa erabiltzen da potasioaren
ordez, ugariagoa eta merkeagoa delako.
ongarri bikoitz moduan erabiltzen da (N eta
K). Leherkarietan ere erabiltzen da. Baina oso gauza gutxitarako
da espezifikoa, eta horregatik sodioa erabiltzen da potasioaren
ordez, ugariagoa eta merkeagoa delako.
– Beste hiru metalek aplikazio praktiko gutxi dituzte, bitxiena zesioarena da, zelula fotoelektrikoetan
METAL ALKALINO EZBERDINAK:
Frantzioa inoiz ez da lortu kantitate neurgarrietan isolatzea. Lehenengo hirurak erraz herdoiltzen dira aire hezean; azkenengo biei babesturik atera zaie argazkia oso erreaktiboak baitira egurats normalean.

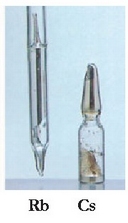
METAL ALKALINO EZBERDINEK URAREKIN EMATEN DUTEN ERREAKZIOA

Metal alkalino lurtarrak
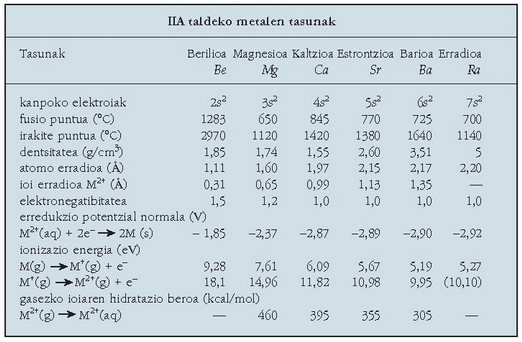
Izen hau ematen zaie II taldeko gaiei: berilioa, magnesioa, kaltzioa,
estrontzioa, barioa eta erradioa dira metal alkalino lurtarrak. Metal alkalino lurtarrak zilar kolorekoak dira, xaflakorrak, harikorrak
eta alkalinoak baino gogorxeagoak. Beren jarduera kimikoaigo egiten da taldean behera egin ahala:
horrela, kaltzioa, estrontzioa eta barioa dira aktiboenak. Kaltzio, estrontzio eta bario oxidoek
(lurrak) izaera basikoa (alkalinoa) dute; hiru elementu horien izena taldeko guztiei zabaldu zaie.
Talde honetako elementu guztien elektroi banaketak gauza bat du berdina, hots, azkenengo geruzan beti
2 elektroi bakarrik daudela 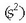 Horregatik bi
elektroi horiek galdu eta aurreko geruza beteta izango dutenez, erraz ioitzen dira (ez alkalinoak bezain erraz halere).
Horregatik bi
elektroi horiek galdu eta aurreko geruza beteta izango dutenez, erraz ioitzen dira (ez alkalinoak bezain erraz halere).
IIA taldeko gaiek osatzen dituzten konposatu gehienek izaera
ionikoa dute, berilioaren konposatuek izan ezik, 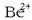 katioiak
karga dentsitate oso handia baitu. Talde honetako gaien erreaktibotasuna alkalinoena baino apalagoa bada ere, talde honetako
gairik ez da agertzen aske izadian. Gai hauek lortzeko, bakoitzari dagokion kloruro fundituen elektrolisia egiten da.
katioiak
karga dentsitate oso handia baitu. Talde honetako gaien erreaktibotasuna alkalinoena baino apalagoa bada ere, talde honetako
gairik ez da agertzen aske izadian. Gai hauek lortzeko, bakoitzari dagokion kloruro fundituen elektrolisia egiten da.
Kaltzioa eta magnesioa oso ugariak dira izadian, karbonato eta sulfato moduan. Berilioa, estrontzioa eta barioa ez dira hain ugariak eta ezagutzen diren erradioaren isotopo guztiak erradiaktiboak dira.
Gai hauen erreakzioak eta alkalinoenak oso antzekoak dira. Berilioa kenduta, gainerako guztiak airean oxidatzen dira eta dagozkien oxidoak sortzen dituzte. Berilio oxidoa izan ezik (BeO), gainerako oxidoak alkalinoak dira eta urarekin erreakzionatzen dute hidroxidoa emanez:
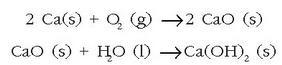
Kaltzioak, estrontzioak eta barioak giro tenperaturan urarekin erreakzionatzen eta hidroxidoa ematen dute:
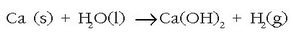
baina magnesioak ur lurrinarekin erreakzionatzen du eta berilioak, aldiz, asko berotuta ere ez:
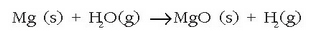
Berilioa sodio hidroxidozko soluzioetan disolbatzen den taldeko elementu bakarra da, hona hemen izaera anfoterikoaren adibide bat. Disolbatutakoan berilato ioi bat sortuko da:
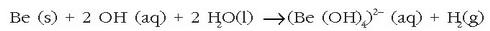
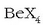 egitura
tetraedrikoa berilioaren ezaugarri kimiko nabarmena da.
egitura
tetraedrikoa berilioaren ezaugarri kimiko nabarmena da.
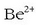 katioia
uretan hidratatu egiten da
katioia
uretan hidratatu egiten da 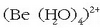 . Ioi txikiaren polarizazio
ahalmena hain handia denez, Be-O loturak sendo samarrak izango dira eta O-H loturak berriz ahulagoak. Horrexegatik ioia
hidrolizatu egiten da eta disoluzio azidoak ematen ditu:
. Ioi txikiaren polarizazio
ahalmena hain handia denez, Be-O loturak sendo samarrak izango dira eta O-H loturak berriz ahulagoak. Horrexegatik ioia
hidrolizatu egiten da eta disoluzio azidoak ematen ditu:
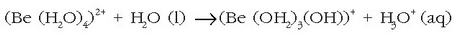
Elementu hauen erabilerak hauek dira:
– Berilioa ez da oso gai erabilia, ez baita oso ugaria izadian eta bere konposatuak
kutsagarriak baitira. Esmeralda harri bitxia berilioaren arrastoek ematen diote. Bere dentsitate apal eta gogortasun handiari esker,
eraikuntzako egiturak osatzeko erabiltzen da. Kobrearekin nahastuta kontaktu elektrikoetan, malguki eta tresna bakartzaileetan
erabili ohi da. X izpietako hodietako leihoak berilioz egiten dira izpi horientzat gardena baita.
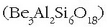 aldaera bat da; kolore berdea
aldaera bat da; kolore berdea
 arrastoek ematen diote. Bere dentsitate apal eta
gogortasun handiari esker, eraikuntzako egiturak osatzeko erabiltzen da. Kobrearekin nahastuta kontaktu elektrikoetan,
malguki eta tresna bakartzaileetan erabili ohi da. X izpietako hodietako leihoak berilioz egiten dira izpi horientzat
gardena baita.
arrastoek ematen diote. Bere dentsitate apal eta
gogortasun handiari esker, eraikuntzako egiturak osatzeko erabiltzen da. Kobrearekin nahastuta kontaktu elektrikoetan,
malguki eta tresna bakartzaileetan erabili ohi da. X izpietako hodietako leihoak berilioz egiten dira izpi horientzat
gardena baita.
– Estrontzioaren gatzak piroteknian erabiltzen dira kolore gorria ematen baitute. Estrontzio metalikoak ez du erabilera aipagarririk.
– Magnesioaren kasuan konposatu gehiago erabiltzen dira. Magnesio oxidoa (MgO) hidroxidoa edo karbonatoa (magnesita) tenperaturaren bidez deskonposatuz lortzen da.
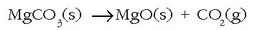
Oxido hau izugarri berotu daiteke funditu edo deskonposatzen hasi baino lehen (2800° C), hots, egonkortasun ter - miko handia dauka. Gainera beroaren eroale ona da; ez, aldiz, elektrizitatearena. Hiru ezaugarri hauei esker berogailu elektrikoetan isolatzaile moduan erabiltzeko substantzia egokia da.
Magnesio metalikoa airean dagoenean erre egiten da eta argi zuri distiratsua ematen du, horregatik argazkiak ateratzeko flashetan eta piroteknian erabili ohi da. Magnesio oxidoa (MgO) amoniozko gatz disolbagarriekin erreakzionatuz gero, magnesio hidroxido bihur daiteke. Hidroxido honen suspentsioa* magnesia esne izenaz ezagutzen da, eta urdaileko antiazido moduan eta libragarri moduan erabiltzen da. Magnesioaren konposaturik ezagunena, halere, klorofila da.
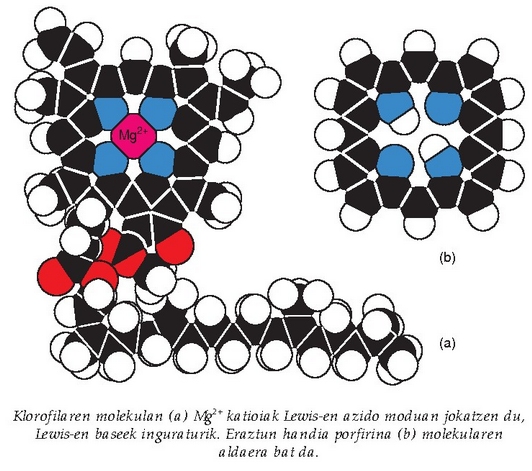
Klorofilaren molekulan magnesio katioiak Lewis azido moduan jokatuko du. Eguzkitiko argia jaso eta energia bihurtzeko bidea ematen du fotosintesiaren bidez.
– Kaltzioa izadian kaltzio karbonato moduan agertzen da, kararri moduan. Marmola kaltzio karbonatoaren aldaera gotorra da eta distiratsu bihur daiteke leunduz. Kaltzio karbonatoaren bi forma ezagunenak kaltzita eta aragonita meak dira. Kaltzio karbonatoa berotuz kare bizia lortzen da (CaO):
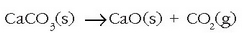
CaO urarekin erreakzionarazten denean hidroxidoa lortzen da, 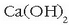 ,
kare hila izenaz ezaguna. Substantzia basiko 2 hau oso merkea denez, industrian oso erabilia da. Kaltzio hidroxidoa harearekin nahastu
,
kare hila izenaz ezaguna. Substantzia basiko 2 hau oso merkea denez, industrian oso erabilia da. Kaltzio hidroxidoa harearekin nahastu
 eta aireko
eta aireko 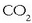 -rekin
kontaktuan dagoenean, gogortu eta kareorea sortzen da (etxeetako hormak eta sabaiak estaltzeko erabilia).
-rekin
kontaktuan dagoenean, gogortu eta kareorea sortzen da (etxeetako hormak eta sabaiak estaltzeko erabilia).
Beste gai aipagarri bat kaltzio sulfato hidratatua da 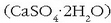 ,
poliki-poliki berotuz gero igeltsua ematen duena
,
poliki-poliki berotuz gero igeltsua ematen duena 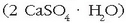 Alabastroa igeltsuaren forma gotorra da, marmolaren antzekoa baina bigunagoa, eta apaingintzan erabiltzen da.
Alabastroa igeltsuaren forma gotorra da, marmolaren antzekoa baina bigunagoa, eta apaingintzan erabiltzen da.
– Barioa pizgailuetako harrietan erabiltzen da, berotutakoan elektroiak igortzen baititu erraztasun handiz. Medikuntzan adibidez X
izpiez gizakiaren hesteak aztertu nahi direnean, bario sulfatozko 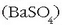 ahi bat ematen da, bario sulfatoak
X izpiak oso ongi xurgatzen baititu
ahi bat ematen da, bario sulfatoak
X izpiak oso ongi xurgatzen baititu
Postrantsizio metalak
Metal hauek bere azkenengo geruzan p elektroiak betetzen ari direnak dira. Hiru talde bereizten dira.
III. taldeko metalak
Talde honetako elementuak boroa, aluminioa, galioa, indioa eta talioa dira, baina lehenengoaren izaera ez da metalikoa, eta hortaz, ez da atal honetan aztertuko.
Aluminioa:
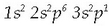 .
Aluminioa lurrazaleko metalik ugariena da (eta elementu guztien artean hirugarrena ugaritasunari dagokionez,
oxigeno eta silizioaren atzetik). Izadian ez da aske aurkitzen, oso erreaktiboa baita. Aluminioa oxido moduan
.
Aluminioa lurrazaleko metalik ugariena da (eta elementu guztien artean hirugarrena ugaritasunari dagokionez,
oxigeno eta silizioaren atzetik). Izadian ez da aske aurkitzen, oso erreaktiboa baita. Aluminioa oxido moduan
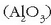 korindoi eta bauxita meetan, espinelan
korindoi eta bauxita meetan, espinelan
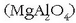 eta aluminosilikato konplexu askotan
eta aluminosilikato konplexu askotan
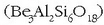 agertzen da. Aluminio metalikoa (Al),
arina da eta korronte elektrikoaren oso eroale ona da; ez da kobrea bezain eroale ona, baina masa unitate bakoitzeko
eroankortasun handiagoa du dentsitate txikiagoa duelako. Aluminioa, bere erredukzio potentzialari begiratuz, erraz oxidatuko
dela pentsa daiteke, baina ez da horrela izaten, aluminio oxido geruza mehe batek babesten baitu barruko metala.
Geruza mehe hori lodiago bihur daiteke aluminio metalikoa zelda elektrolitiko bateko anodo moduan lanean jarriz gero.
Lortuko den materiala aluminio anodizatua da, etxegintzan oso erabilia (zelda elektrolitikoko soluzioari tinturak gehituz
geruzaren kolorea alda daiteke). Aluminioa lortzeko modurik arruntena bauxita meatik lortutako aluminaren
agertzen da. Aluminio metalikoa (Al),
arina da eta korronte elektrikoaren oso eroale ona da; ez da kobrea bezain eroale ona, baina masa unitate bakoitzeko
eroankortasun handiagoa du dentsitate txikiagoa duelako. Aluminioa, bere erredukzio potentzialari begiratuz, erraz oxidatuko
dela pentsa daiteke, baina ez da horrela izaten, aluminio oxido geruza mehe batek babesten baitu barruko metala.
Geruza mehe hori lodiago bihur daiteke aluminio metalikoa zelda elektrolitiko bateko anodo moduan lanean jarriz gero.
Lortuko den materiala aluminio anodizatua da, etxegintzan oso erabilia (zelda elektrolitikoko soluzioari tinturak gehituz
geruzaren kolorea alda daiteke). Aluminioa lortzeko modurik arruntena bauxita meatik lortutako aluminaren
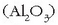 elektrolisia da. Prozesu honek Hall prozesu izena du.
Bertan bauxitatik lortutako alumina
elektrolisia da. Prozesu honek Hall prozesu izena du.
Bertan bauxitatik lortutako alumina 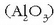 kriolita urtuan
kriolita urtuan
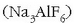 disolbatu eta karbonozko elektrodoak erabiliz elektrolisia
gertatzen da:
disolbatu eta karbonozko elektrodoak erabiliz elektrolisia
gertatzen da:
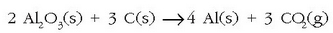
Erredox erreakzio honetan
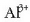 katioiak Al moduan jalkitzen dira katodoan.
katioiak Al moduan jalkitzen dira katodoan.
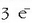 behar direnez, elektrizitate kontsumoa oso handia da.
Horregatik aluminioa berziklatzea beharrezkoa da, merkeagoa baita aluminioa berziklatzea aluminioa lortzea baino.
behar direnez, elektrizitate kontsumoa oso handia da.
Horregatik aluminioa berziklatzea beharrezkoa da, merkeagoa baita aluminioa berziklatzea aluminioa lortzea baino.

Aluminioaren dentsitate txikiari, lortzeko erraztasunari eta herdoilgaiztasunari esker, oso erabilia da material hau etxeen eraikuntzan. Hegazkinetan erabiltzeko kobre eta silikonarekin nahastu ohi da.
Alumina 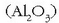 egitura kristalino ezberdinetan agertzen da.
Adibidez a-alumina deiturikoa oso substantzia gogorra da, korindoi izenekoa (Mohsen gogortasun taulan azkenaurreko substantzia);
r- alumina forma berriz arinagoa eta erreaktiboagoa da eta kromatografian erabiltzen da. Aluminaren forma ez puru batzuk oso aintzat
hartuak dira:
egitura kristalino ezberdinetan agertzen da.
Adibidez a-alumina deiturikoa oso substantzia gogorra da, korindoi izenekoa (Mohsen gogortasun taulan azkenaurreko substantzia);
r- alumina forma berriz arinagoa eta erreaktiboagoa da eta kromatografian erabiltzen da. Aluminaren forma ez puru batzuk oso aintzat
hartuak dira: 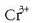 baldin badu errubi bat izango da,
baldin badu errubi bat izango da,
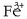 eta
eta 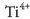 baditu zafiroa, eta
baditu zafiroa, eta 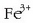 duenean topazioa.
duenean topazioa.

Galioa, indioa eta talioa
aluminioa baino askoz ere urriagoak dira eta sulfuro moduan agertu ohi dira. Metal horiek lortzeko beren gatzen ur soluzioen elektrolisia egiten da. Galioa oso erraz funditzen da, aski da eskuetan hartzea, eta ez du erabilera aipagarririk. Indioa berriz metal bigun urdina da, zilarrarekin eta berunarekin nahastuta eroale termikoetan erabili ohi da, oso erabilia da elektronikaren munduan. Talioa metal biguna da, berunaren antzekoa, oso kutsagarria, eta ez da apenas erabiltzen.
IV. taldeko metalak
IV taldean karbonoa, silizioa, germanioa, eztainua eta beruna daude. Lehenengo biak ez-metalak dira, beraz azken hiruak bakarrik aztertuko dira hemen
- Germanioa
gauza askotan silizioaren antzekoa da eta erabilteremu berdintsua dute biek:
erdieroaleetan hain zuzen ere. Germanioa sulfuro moduan agertzen da zink eta artsenikoarekin batera,
eta sulfuro konplexu moduan zilar eta kobrearekin nahastuta. Meatxigortua kloratuz germanioa lor daiteke.
Lehenengo, germanio kloruroa bereizten da destilazioz (irakite puntu apala baitauka), gero kloruroa
hidrolizatzen da 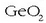 lortzeko eta, azkenik, oxidoa
karbono eta hidrogenoarekin erreduzituz germanioa lortzen da
lortzeko eta, azkenik, oxidoa
karbono eta hidrogenoarekin erreduzituz germanioa lortzen da
- Eztainua eta beruna
aspaldidanik ezagutzen diren gaiak dira. Eztainua kasiterita meatik
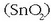 lortzen da nagusiki,
karbonoarekin erreduzituz 1.200° C-tan:
lortzen da nagusiki,
karbonoarekin erreduzituz 1.200° C-tan:
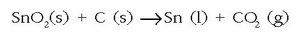
Eztainua zenbait aleaziotan erabiltzen da: soldatzeko erabiltzen direnetan berunarekin nahastuta, brontzea emateko kobrearekin nahastuta, etab. Baina latorria egiteko erabiltzen den nahastea da ezagunena. Burdinazko xaflak eztainu fundituan murgilduz xaflak eztainuzko xafla mehe batez estaltzen dira.
Beruna gai zuri urdinxka da, xaflakorra. Berun iturri nagusia galena
(PbS) da; airearekin berotuta oxidatu ondoren erredukzioz (ikatzarekin)
Pb lortzen da. Beruna oso egonkorra da oso gutxi
erreakzionatzen baitu, horregatik erabil daiteke etxeetako eraikuntzan,
edo azido sulfuriko kontzentratuaren garraioan. Oso aspalditik
da ezaguna eta erabilia: Erroma klasikoan soldaduak zeuden
lekuetara ura eramateko berunezko hodiak erabiltzen ziren, ardoa
gordetzeko ontziak ere berunez gainestalirik zeuden, etab. Historialari
batzuen ustez hainbesterainokoa izan zen berunaren erabilera,
nagusiki jende dirudunaren artean, ezen berunak eragindako
gaisotasunak (zoroaldiak, antzutasuna, …) izan ziren Erromatar
inperioaren beherakadaren eragileetako bat. Bestalde, dentsitatehandia duenez eta bere elektroiek
erradiazioa absorbatzen dutenez, X izpietako tresnetan babesgarri gisa erabiltzen da.
Hotsaren bakartzaile edo isolatzaile gisa ere erabiltzen da, bere atomo astunek oso mantso mugitzen
eta transmititzen dituztelako hots uhinak. Gaur egun, akumuladoreetan erabiltzen da batez ere.
(Gasolina lortzeko erabili izan da urte askotan tetraetil beruna, 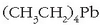 ,
baina bere kutsagarritasuna ikusirik gaur egun gero
eta gutxiago erabiltzen da).
,
baina bere kutsagarritasuna ikusirik gaur egun gero
eta gutxiago erabiltzen da).
Argi halogenoak
Bonbila inkandeszente batean, tenperaturak gora egin ahala, argitasunak eta etekinak ere handiagoak izan beharko lukete. Izan ere, irradatzen den argiaren intentsitatea tenperaturarekin proportzionala baita. Bada ordea arazo txiki bat. Bonbila arrunt bat 2.000 °C berotzen da, eta tenperatura horretan harizpiaren wolframioa – wolframioaren fusio tenperatura 3.886 °C izan arren– sublimatu egiten da kantitate txikitan, eta bonbilaren alde hotzenetan kondentsatzen, ondoren. Erabileraren erabileraz, bonbilaren wolframiozko harizpia mehetu egingo da zenbait lekutan, eta hauskorrago bihurtu. Gertaera hori areagotu egiten da tenperatura handitzean, eta hala, argi intentsitatea handitzearren tenperatura handitzean, murriztu egiten da bonbilaren iraupena. Nola konpondu arazo hori? Bonbila halogenoa da aurkitu den konponbideetako bat. Bonbila horien funtzionatzeko era erreakzio kimiko honetan oinarritzen da:
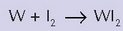
Erreakzio horrek, tenperatura apaletan, eskuin aldera egiten du, eta tenperatura garaietan, berriz, ezker aldera. Halogeno guztiek antzeko portaera dute. Bonbila batean gai halogeno bat izanik –iodoa, adibidez–, harizpi berotik ihes egindako wolframio atomoak wolframio ioduro bihurtzen dira bonbilaren alde hotzenetan. Wolframio ioduro hori bonbilaren hormetan itsasten da, baina gai hegaskorra izanik, 2.500 °C-tan lurruntzen eta harizpira iristen da berriro, eta han, tenperatura garai hori dela eta, wolframio gisa askatzen da berriz ere. Wolframioa, beraz, etengabe ibiltzen da bonbilaren leku batetik bestera, eta horrela, harizpiak ez du galera handirik.
Bonbila halogenoak ehundaka ordu iraun dezake 2.700 °C-tan, baina bonbila arruntak baino beira sendoagoz egina behar du izan, kuartzoz, esate baterako. Bonbila halogenoek, beraz, bonbila arruntek baino askoz ere etekin handiagoa ematen dute, arruntek baino bi aldiz argi ahalmen handiagoa dute batzuek
SODIOAREN PROPIETATE FISIKOAK
Sodioa, metala izanik, oso biguna da eta erraz moztu daiteke aizto batekin. Metal distiratsua da, baina berehala galtzen du distira, eguratseko oxigenoarekin oxidatzen delarik, eta elektrizitatearen eroale ona da.
Sodioa 97,5°C-tan urtzen da. Saio hodi batean jarri eta ur irakinetan berotuz gero, merkurioaren itxurako bola metaliko bat eratzen du.


V. taldeko elementuak
Talde hau osatzen duten elementuak nitrogenoa, fosforoa, artsenikoa, antimonioa eta bismutoa dira., baina azken biak bakarrik dira metalak (taula periodikoan periodo batean ezkerretik eskuinera egin ahala, izaera metalikoa ahultzen doa, eta talde batean goitik behera egin ahala handitu egiten da).
Antimonioa
metal gris bikortsua da. Normalean antimonitatik 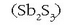 lortzen da, burdinarekin erreduzituz:
lortzen da, burdinarekin erreduzituz:

edo 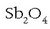 oxidoarekin txigortu ondoren
karbonoarekin erreduzituz:
oxidoarekin txigortu ondoren
karbonoarekin erreduzituz:
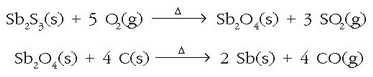
Antimonioaren ezaugarri berezietako bat da hoztean bolumena handitzen zaiola, horregatik asko erabiltzen da objektuak moldeatzeko nahastea prestatzeko. Nahaste edo aleazio askotan erabiltzen da gogortasuna emateko eta herdoilaren kontrako babesgarri gisa.
- Bismutoa
dentsitate handiko metala da; kolore horixka du. Batzuetan aske aurki daiteke izadian eta askotan bismuto oxido
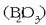 edo bismuto sulfuro bezala
edo bismuto sulfuro bezala
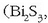 bismuto distiratsua).
Antimonioaren antzera, hoztutakoan bere bolumena handiagoa egiten da eta
horregatik fusio puntu apaleko aleazio askotan erabiltzen da, moldeaturiko objektuen itxura asko hobetzen baita.
Bismutozko aleazio batzuk (fusio puntu apalekoak) suteen aurkako alarma sistemetan,
ureztatzeko sistema automatikoetan eta fusible elektrikoetan erabiltzen dira. Medikuntzan bismuto azpikarbonatoa
bismuto distiratsua).
Antimonioaren antzera, hoztutakoan bere bolumena handiagoa egiten da eta
horregatik fusio puntu apaleko aleazio askotan erabiltzen da, moldeaturiko objektuen itxura asko hobetzen baita.
Bismutozko aleazio batzuk (fusio puntu apalekoak) suteen aurkako alarma sistemetan,
ureztatzeko sistema automatikoetan eta fusible elektrikoetan erabiltzen dira. Medikuntzan bismuto azpikarbonatoa
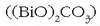 eta azpinitratoa
eta azpinitratoa
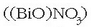 erabiltzen dira urdaileko eta larruazaleko
gaisotasunak sendatzeko.
erabiltzen dira urdaileko eta larruazaleko
gaisotasunak sendatzeko.
Bismutoaren oxidazio egoera arruntena +3 da, batzuetan, oso gutxitan, +5 oxidazio zenbakiarekin agertzen da. Bi(III)-ren konposatuak eta Sb(III)-renak oso antzekoak dira.
Erreakzio ezagunenak:
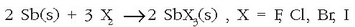
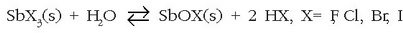
Elementu adierazkorren artean geldituko litzatekeen metal bakarra polonioa da (Po) (VI taldean), baina elementu horren isotopo erradiaktiboak bakarrik ezagutzen direnez, ez da hemen aztertuko
Trantsizio metalak
Kimika gaien taularen erdialdekoei deitzen zaie trantsizio metal. Taularen ezkerrealdeko gaien (alkalinoak edo baseak ematen zituztenak) eta eskuinekoen (azidoak ematen zituztenak) arteko gaitzat hartu ziren eta hortik datorkie izena. Gaur egun trantsizio metalak d eta f geruza elektronikoak betetzen ari diren gaiak dira; gai hauek guztiak metalikoak dira. Baina denak trantsizio gaiak baldin badira ere, trantsiziokoak esaten denean d geruza betetzen ari direnak ulertzen da; f geruza betetzen ari direnei barne-trantsizioko gai esaten zaie. Talde honetan gai ugari daude, baina badituzte tasun edo propietate orokor batzuk eta tasun horiek azalduko da lehenik eta gai metalikoen azterketa egingo da ondoren.
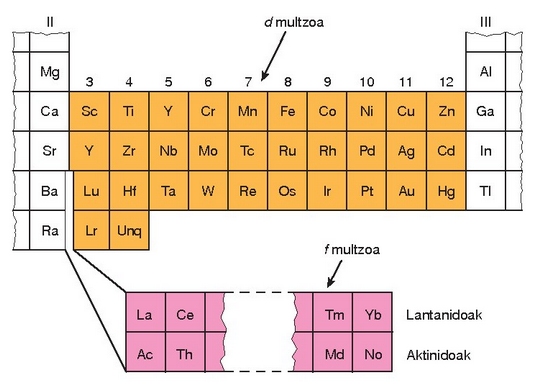
Hauek dira d trantsizio gaien propietateak:
Denak metalikoak dira.
Trantsiziokoak ez diren metalak baino gogorragoak eta hauskorragoak dira, haiek baino fusio eta irakite puntu garaiagoa dute eta lurrintze entalpia handiagoa.
Ematen dituzten ioiak eta konposatuak koloredunak izan ohi dira.
Ioi konplexu asko ematen dituzte.
Oxidazio egoera asko dituzte, oro har.
Oro har, trantsizio metalak edo beren konposatuak katalizatzaile onak izaten dira.
Trantsizio metal askok erabilera aipagarriak dituzte. Batzuk oso gogorrak eta egonkorrak dira, eta hainbat egitura osatzeko erabili ohi dira, adibidez burdina eta altzairuak. Altzairuak burdina eta beste trantsizio elementu baten nahasketak izaten dira (banadioa, kromoa, manganesoa, kobaltoa edo nikela). Trantsizioko beste elementu zenbait oso erabiliak dira inerteak izanik ia oxidaezinak direlako; adibidez urrea, zilarra edo platinoa. Beste batzuk, izaki bizidunetan oso kantitate urrian agertu arren, ezinbestekoak dira izaki bizidunen funtzionamendurako, adibidez burdinak hemoglobinan duen funtzioa edo entzima batzuetan kobrea, burdina edo zinka agertzea
Trantsizio elementu guztien deskribapena egiteak oso luze joko luke, horregatik ezagunenak edo erabilienak aipatuko ditugu soilik
Kromoa
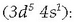 Elementu hau gure egunoroko bizitzan arrunt samarra da; autoetako zenbait osagairen babesle
moduan erabiltzen da, edo altzairuz egindako gai askoren itxura hobetzeko eta korrosioaren
aurrean egonkortasuna emateko. Kromoa lortzeko iturririk nagusiena kromita da
Elementu hau gure egunoroko bizitzan arrunt samarra da; autoetako zenbait osagairen babesle
moduan erabiltzen da, edo altzairuz egindako gai askoren itxura hobetzeko eta korrosioaren
aurrean egonkortasuna emateko. Kromoa lortzeko iturririk nagusiena kromita da
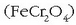 .
Kromita ikatzarekin labe elektriko batean erreduzitzen da eta burdinaz eta dromoz osaturiko
nahastea ematen du. Kromoak, beste trantsizio metal askoren antzera, oxidazio egoera bat baino
gehiago ditu.Handiena +6 da. Oxidazio egoera honetan dagoenean oso elektronegatiboa da eta
ez-metal baten portaera du. Oxidazio egoera honetan kromato etadikromato ioi aipagarriak
eratzen dira. Kromato ioiak
.
Kromita ikatzarekin labe elektriko batean erreduzitzen da eta burdinaz eta dromoz osaturiko
nahastea ematen du. Kromoak, beste trantsizio metal askoren antzera, oxidazio egoera bat baino
gehiago ditu.Handiena +6 da. Oxidazio egoera honetan dagoenean oso elektronegatiboa da eta
ez-metal baten portaera du. Oxidazio egoera honetan kromato etadikromato ioi aipagarriak
eratzen dira. Kromato ioiak 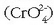 kolore horia dauka eta sulfato ioiaren egitura tetraedriko bera du. Dikromato ioiaren egitura
kolore horia dauka eta sulfato ioiaren egitura tetraedriko bera du. Dikromato ioiaren egitura
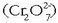 disulfato ioiaren antzekoa da.
Potasio dikromatoa kolore gorri-laranja dauka. Dikromato-kromato ioien artean oreka dago eta sistemaren
baldintzak aldatuz (pH-a hain zuzen ere) bata beste bihur daiteke:
disulfato ioiaren antzekoa da.
Potasio dikromatoa kolore gorri-laranja dauka. Dikromato-kromato ioien artean oreka dago eta sistemaren
baldintzak aldatuz (pH-a hain zuzen ere) bata beste bihur daiteke:
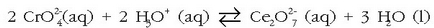
+6 oxidazio egoeran kromoa oso oxidatzaile sendoa da. Bai dikromatoa 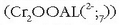 ,
bai kromo (VI) oxidoa
,
bai kromo (VI) oxidoa 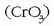 asko erabiltzen dira oxidatzaile moduan, adibidez alkoholak zetona edo aldehidoetara oxidatzeko garaian.
asko erabiltzen dira oxidatzaile moduan, adibidez alkoholak zetona edo aldehidoetara oxidatzeko garaian.
Laboratorioan erabiltzeko oso oxidatzaile garrantzitsuak badira ere, industrian erabiltzeko garesti samarrak dira eta normalagoa da oxigenoa erabiltzea (tenperatura egokietan eta katalizatzaileen laguntzarekin). Laboratorioan oso erabilia da «nahaste kromiko» deritzana, azido sulfuriko kontzentratua dikromato potasikozko disoluzio aseari gehituz lortzen dena. Oso erabilia da tr esnetako koipea garbitzeko.
Kromoaren oxidazio egoerarik egonkorrena 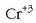 da.
Kromo (III) hidroxidoa anfoteroa da eta ongi disolbatzen da inguru azidoetan eta basikoetan
da.
Kromo (III) hidroxidoa anfoteroa da eta ongi disolbatzen da inguru azidoetan eta basikoetan
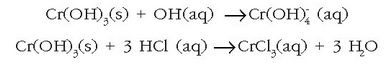
Kromo (III) oxidoa fusio puntu
garaia duen gai egonkorra da. Kormo metalikoa airearekin nahastua dagoenean, kanpoko geruzan kromo (III)
oxidoa osatu 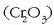 eta honek barruko kromo metalikoa
babesten du. Oxido hau tindagai berde gisa erabiltzen da
pinturetan
eta honek barruko kromo metalikoa
babesten du. Oxido hau tindagai berde gisa erabiltzen da
pinturetan
Manganesoa
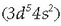 :
manganesoa lortzeko mearik garrantzitsuena pirolusita da
:
manganesoa lortzeko mearik garrantzitsuena pirolusita da 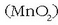 ;
oxido hori karbonoaren edo karbono monoxidoarekin erreduzituz lortzen da (Mn). Manganesoak berak ez du erabilera
aipagarririk, baina ferromanganeso moduan, hots, burdina eta manganesozko nahastea gisa erabili ohi da; altzairua
egiteko erabili ohi da, adibidez manganesozko %12 eta karbonozko %1 duen altzairua oso gogorra eta egonkorra da.
;
oxido hori karbonoaren edo karbono monoxidoarekin erreduzituz lortzen da (Mn). Manganesoak berak ez du erabilera
aipagarririk, baina ferromanganeso moduan, hots, burdina eta manganesozko nahastea gisa erabili ohi da; altzairua
egiteko erabili ohi da, adibidez manganesozko %12 eta karbonozko %1 duen altzairua oso gogorra eta egonkorra da.
Manganesoa +4 oxidazio egoeran dagoenean bitarteko egoeran dagoela esaten da, eta adibidez
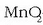 -ren kasuan bai oxidatzaile,
bai erreduzitzaile moduan joka dezake. +6 oxidazio egoerandagoenean eratzen diren konposatuak bere gatzak dira,
hots, manganatoak
-ren kasuan bai oxidatzaile,
bai erreduzitzaile moduan joka dezake. +6 oxidazio egoerandagoenean eratzen diren konposatuak bere gatzak dira,
hots, manganatoak 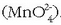 Ioi hau egonkorra da
bakarrik ingurune basikoan, manganatozko disoluzio bati azidoa gehitutakoan permanganato
Ioi hau egonkorra da
bakarrik ingurune basikoan, manganatozko disoluzio bati azidoa gehitutakoan permanganato
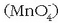 oxidazio egoera +7) eta manganeso dioxidoa
oxidazio egoera +7) eta manganeso dioxidoa
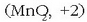 emanez deskonposatzen baita:
emanez deskonposatzen baita:

Erreakzio hori itzulgarria denez,
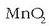 hauspeakin beltza duen permanganatozko
disoluzio purpura bati
hauspeakin beltza duen permanganatozko
disoluzio purpura bati 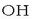 ioiak gehituz gero
manganatozko
ioiak gehituz gero
manganatozko 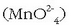 disoluzio berdea lortzen da.
disoluzio berdea lortzen da.
Potasio permanganatozko soluzioak oso oxidatzaile sendoak dira eta ura arazteko edo desinfektatzaile moduan erabiltzen dira
Burdina, kobalto eta nikela:
hiru metal hauek ferromagnetikoak dira, hau da, eremu magnetiko batean ipini ondoren magnetizatuta gelditzen dira. Baita eremu horretatik kendu ondoren ere. Atomoen spinak eremu magnetizatuarekin lerrokatzen direlako dute propietate hau.
Burdinaren banaketa elektronikoa 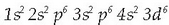 da.
Trantsizio metal erabiliena da eta berau da, halaber, ugarienetakoa (lurrazaleko ugariena aluminioaren ondoren).
Hala ere, oso gutxitan agertzen da izadian aske; gehienetan nikelarekin nahasturik agertzen da.
Lurraren gunearen osagai nagusietakoa da eta meteoritoetan ere agerten da. Burdina iturri nagusiak
hematitea
da.
Trantsizio metal erabiliena da eta berau da, halaber, ugarienetakoa (lurrazaleko ugariena aluminioaren ondoren).
Hala ere, oso gutxitan agertzen da izadian aske; gehienetan nikelarekin nahasturik agertzen da.
Lurraren gunearen osagai nagusietakoa da eta meteoritoetan ere agerten da. Burdina iturri nagusiak
hematitea 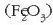 magnetita,
magnetita,
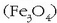 eta siderita
eta siderita
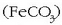 dira. Pirita, (burdina(II) sulfuroa, FeS),
ere aipagarria da, eta «txepelen urre» izenaz ezaguna da, urrearen antza duelako. Burdina purua zilar kolorekoa
da eta bigun samarra; burdina garbia (karbono, oxigeno, nitrogeno, fosforo, sufrerik gabe) lortzea gauza zaila da,
eta gainera ez du erabilera garrantzizkorik. Industrian ekoizten den burdina guztia nahasteetan agertzen dela esan daiteke,
altzairuetan hain zuzen er e. Altzairuan burdinarekin batera, karbonoa eta trantsizio metal batzuk
agertzen dira (nikel, kromo, manganeso edo banadioa). Altzairua burdina baino askoz ere gogorragoa eta zailagoa da,
eta asko erabiltzen da eraikuntzan, itsasontzietan, autoetan, etab.
dira. Pirita, (burdina(II) sulfuroa, FeS),
ere aipagarria da, eta «txepelen urre» izenaz ezaguna da, urrearen antza duelako. Burdina purua zilar kolorekoa
da eta bigun samarra; burdina garbia (karbono, oxigeno, nitrogeno, fosforo, sufrerik gabe) lortzea gauza zaila da,
eta gainera ez du erabilera garrantzizkorik. Industrian ekoizten den burdina guztia nahasteetan agertzen dela esan daiteke,
altzairuetan hain zuzen er e. Altzairuan burdinarekin batera, karbonoa eta trantsizio metal batzuk
agertzen dira (nikel, kromo, manganeso edo banadioa). Altzairua burdina baino askoz ere gogorragoa eta zailagoa da,
eta asko erabiltzen da eraikuntzan, itsasontzietan, autoetan, etab.
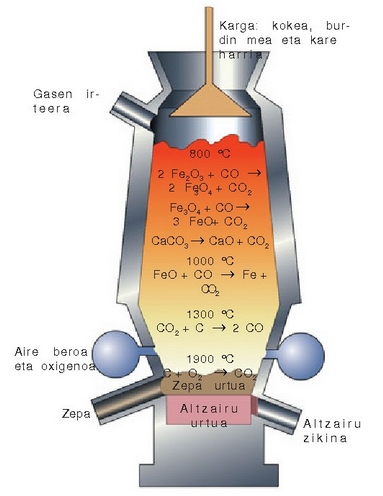
Burdinaren industria labe garaietan egiten da.
Historiaurrean burdina prestatzeko burdin mea ikatzarekin berotzen zen buztinezko marmita batean.
Gaur egun labe garaietan erabiltzen den prozedura erreakzio horretan oinarritua da. Burdinazko lehengaia,
kokea (ikatza) eta kararria 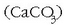 labe garai
baten ahotik isurtzen dira,labearen azpialdetik aire edo oxigenoaz putz egitean. Labeko tenperatura
altuari esker ikatza (kokea) karbono monoxido bihurtzen
da (CO(g)):
labe garai
baten ahotik isurtzen dira,labearen azpialdetik aire edo oxigenoaz putz egitean. Labeko tenperatura
altuari esker ikatza (kokea) karbono monoxido bihurtzen
da (CO(g)):
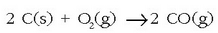
Burdin mea burdin oxidoez
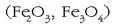 eta silikatoez osaturiko nahaste bat da,
eta labean zehar jaisten den neurrian erreduzitu egiten da. Lehenengo urratsean FeO emango du eta azkenik labearen
azpialdean, zatirik beroenean, burdina galdatua. Erreakzio osoa hauxe da:
eta silikatoez osaturiko nahaste bat da,
eta labean zehar jaisten den neurrian erreduzitu egiten da. Lehenengo urratsean FeO emango du eta azkenik labearen
azpialdean, zatirik beroenean, burdina galdatua. Erreakzio osoa hauxe da:
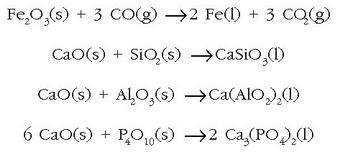
Labegarai batean gertatzen diren erreakzioen eskema.
Erredukzio honekin batera kararria deskonposatu egiten da kaltzio oxidoa emateko eta CaO oxidoak silizezko
zikinekin erreakzionatuko du zepa geruza bat emanez 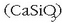 .
Antzera gertatuko da beste substantzia batzuen ezpurutasunekin. Zepa hori burdina baino arinagoa denez
haren gainean geldituko da eta babestu egingo du burdinaren oxidazioa gerta ez dadin.
.
Antzera gertatuko da beste substantzia batzuen ezpurutasunekin. Zepa hori burdina baino arinagoa denez
haren gainean geldituko da eta babestu egingo du burdinaren oxidazioa gerta ez dadin.
Labe garaitik ateratzen den produktuari burdina gordin esaten zaio.Bere osaera hauxe da gutxi gorabehera: burdina nagusiki, %4 kar - bono, %2 silizio eta beste substantzia batzuk kantitate oso txikitan (fosforoa edo sufrea). Burdina gordinari zikinak kentzeko oxigenoa pasarazten da hartan zehar. Gaur egun oxigenoa eta kaltzio karbonato birrindua metal fundituan zehar pasarazten dira. Horrela zikinen oxidoak sortzen dira eta gas moduan ihes egingo dute edo gehitzen den CaO-rekin batera zepa sortu.
Horrela lortzen da altzairua. Substantzia askori ematen zaie altzairu jenero izena; gai horien bereizgarria osagai duten karbono kantitatea da (%0,2tik hasita %1,5era). Gero beste metal batzuk eransten zaizkio (nikela, kromoa, manganesoa, wolframioa edo banadioa) eta altzairu mota desberdinak lortzen dira horrela. Denetan ezagunena altzairu herdoilgaitza da: %18 kromoa eta %8 nikela da.

Labegaraia lanean.
Burdinaren propietate bitxienetakoa ferromagnetismoarena da. Burdinazko lagin bat eremu magnetiko baten eraginpean jarriz gero, burdina magnetizatu egingo da eta eremu magnetikoaren eraginpetik kendu ondoren ere magnetizaturik iraungo du.
Burdina oso erreaktiboa da, eta egurats hezetan herdoildu egiten da.
Burdinaren gainaldean sortzen den herdoila burdina (III) oxido hidratatua da 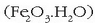 ,
marroi horixka. Burdina herdoil dadin bi osagai horiek behar dira, oxigenoa eta ura.
Lehenengo oxidazioa gertatzen da:
,
marroi horixka. Burdina herdoil dadin bi osagai horiek behar dira, oxigenoa eta ura.
Lehenengo oxidazioa gertatzen da:
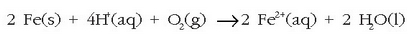
Bigarren urratsean, oxidazioaren ondorioz 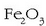 oxido disolbaezina lortzen da:
oxido disolbaezina lortzen da:
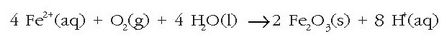
Beraz,
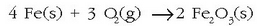
Aluminioari ere antzera gertatzen zaio, baina kasu honetan oxidoak geruza mehe bat eratzen du metalaren inguruan eta oxidazioaren kontra babesten du. Burdinaren kasuan berriz ez da honelakorik gertatzen; burdin (III) oxidoa ezkaten moduan askatzen da

eta burdina erabat herdoiltzen da. Burdina herdoilaren kontra babesteko moduak badira ordea; arruntena altzairua da,
baina badira beste batzuk ere. Adibidez, burdina beste metal baten (adibidez eztainua edo kromoa) geruza mehe batez estaliz gero,
metal horrek edo metal horren oxidoak babestuko du. Zinka erabiltzen denean, hidroxikarbonatozko geruza baten bidez gelditzen da
babestuta burdina  ; horrela babesturiko burdinari burdin
galbanizatu esaten zaio. Beste batzuetan pintura erabiltzen da babesgarri gisa; ezagunena minio izenekoa berunezko pintura bat da.
Bestalde, burdinak azido askorekin erreakzionatzen du eta dagokion burdin (II) gatza osatzen du erreakzio honen bidez:
; horrela babesturiko burdinari burdin
galbanizatu esaten zaio. Beste batzuetan pintura erabiltzen da babesgarri gisa; ezagunena minio izenekoa berunezko pintura bat da.
Bestalde, burdinak azido askorekin erreakzionatzen du eta dagokion burdin (II) gatza osatzen du erreakzio honen bidez:
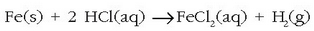
Kobaltoaren banaketa elektronikoa
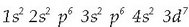 da. Kobaltoa ez da oso elementu ugaria eta sulfuro eran
(CoS) agertzen da batez ere, gehienetan nikel sulfuroarekin eta kobre sulfuroarekin batera. Kobalto metala lortzeko,
kobalto (III) oxidoa
da. Kobaltoa ez da oso elementu ugaria eta sulfuro eran
(CoS) agertzen da batez ere, gehienetan nikel sulfuroarekin eta kobre sulfuroarekin batera. Kobalto metala lortzeko,
kobalto (III) oxidoa 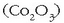 lortu behar da kobalto mea
airearekin nahastu eta txigortuz. Kobalto oxidoa oxido ezpurua da; kaltzio hidroxidoa
lortu behar da kobalto mea
airearekin nahastu eta txigortuz. Kobalto oxidoa oxido ezpurua da; kaltzio hidroxidoa
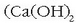 edo sodio karbonatoa
edo sodio karbonatoa
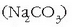 erantsiz gero, azido sulfurikotan disolbatu
eta hidroxidoa hauspeatuko da (Co(OH) 3 ). Hidroxido hori berotuz oxido purua lortuko da eta hidrogeno edo karbonoarekin
erreduzituz kobalto metalikoa (Co). Kobaltoa aleazio bereziak prestatzeko erabiltzen da, adibidez Alnico izeneko nahastea
prestatzeko (kobalto, nikel, aluminio eta kobrez osaturiko nahastea), imanak egiteko erabili ohi dena.
erantsiz gero, azido sulfurikotan disolbatu
eta hidroxidoa hauspeatuko da (Co(OH) 3 ). Hidroxido hori berotuz oxido purua lortuko da eta hidrogeno edo karbonoarekin
erreduzituz kobalto metalikoa (Co). Kobaltoa aleazio bereziak prestatzeko erabiltzen da, adibidez Alnico izeneko nahastea
prestatzeko (kobalto, nikel, aluminio eta kobrez osaturiko nahastea), imanak egiteko erabili ohi dena.
Nikelaren banaketa
elektronikoa 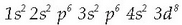 da. Bere formarik ezagunena sulfuroa da
(NiS) eta normalean kobre sulfuro eta burdina sulfuroarekin batera agertzen da (CuS eta FeS). Kontzentrazio handi samarretan
agertzen da; hori dela eta meategi gutxitan ustiatzen da, Sudburyn (Canada) eta Ertafrikan (Africa Central). Metala lortzeko
mea txigortuz oxidoa lortzen da lehenik, eta oxidoaren erredukzioz ateratzen da nikel metalikoa. Nikel honek ezpurutasunak dauzka,
besteak beste kobrea eta burdina. Purifikatzeko karbono monoxidozko (CO) korrontea pasarazten da nikelean zehar, 80° C-tan;
nikelak erreakzionatu eta nikel tetrakarboniloa
da. Bere formarik ezagunena sulfuroa da
(NiS) eta normalean kobre sulfuro eta burdina sulfuroarekin batera agertzen da (CuS eta FeS). Kontzentrazio handi samarretan
agertzen da; hori dela eta meategi gutxitan ustiatzen da, Sudburyn (Canada) eta Ertafrikan (Africa Central). Metala lortzeko
mea txigortuz oxidoa lortzen da lehenik, eta oxidoaren erredukzioz ateratzen da nikel metalikoa. Nikel honek ezpurutasunak dauzka,
besteak beste kobrea eta burdina. Purifikatzeko karbono monoxidozko (CO) korrontea pasarazten da nikelean zehar, 80° C-tan;
nikelak erreakzionatu eta nikel tetrakarboniloa 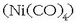 emango du horrela.
Konposatu honen irakite puntua 43° C-koa denez, destilatu eta 200° C-tara berotuz berriro ere, nikel eta karbono monoxidoa emango ditu
deskonposatu ondoren:
emango du horrela.
Konposatu honen irakite puntua 43° C-koa denez, destilatu eta 200° C-tara berotuz berriro ere, nikel eta karbono monoxidoa emango ditu
deskonposatu ondoren:
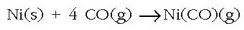
Kobrea, zilarra eta urrea:
talde bereko metalak dira hirurak eta beren banaketa elektronikoa 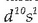 da.
Beren nukleoaren karga handia
dela eta, elektroi gutxi behar dituzte konposatuak eratzeko, hau da, oxidazio egoera gutxi ezagutzen dira.
Arruntena +1 da, baina batzuetan +2 edo +3 ere agertzen dira.
da.
Beren nukleoaren karga handia
dela eta, elektroi gutxi behar dituzte konposatuak eratzeko, hau da, oxidazio egoera gutxi ezagutzen dira.
Arruntena +1 da, baina batzuetan +2 edo +3 ere agertzen dira.
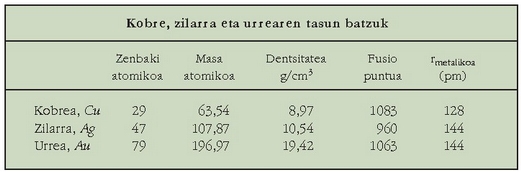
Kobrea, urrea eta zilarra ez dira oso ugariak izadian, baina aspaldidanik ezagutzen dira, elementu aske gisa agertzen baitira. Bigun samarrak dira, harikorrak eta xaflakorrak; fusio puntu apala dute. Zilar kolorea da metalen artean kolore arruntena, eta kobrearen kolore gorrixka eta urrearen kolore horia, aldiz, oso bitxiak dira. Urrea oso metal preziatua izan da beti, bitxigintzan oso erabilia, ia geldoa baita eta kolore eder eta distiratsua baitu; gehienetan beste metal batzuekin (kobrearekin, zilarrarekin, etab.) nahastuta erabiltzen da, ordea, oso biguna delako bestela. Metalen artean bera da harikorrena eta xaflakorrena; urrezko 10 nm-ko xaflak lor daitezke. Kobre eta zilar aleazioa, legezko zilar izenaz ezaguna, ere erabiltzen da bitxigintzan. Kobrea, urrea eta zilarra hirurak erabili izan dira txanponak egiteko, baina gaur egun urrea eta zilarra alde batera utzi dira oso garestiak direlako.
Zilarra Ag moduan agertzen da izadian, baina argentita
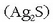 eta kloroargirita (AgCl) meatan ere agertzen da.
Argentitatik zilarra lortzeko sodio zianuroarekin erreakzionarazten da eta zinka gehitzen zaio zilar metalikoa hauspea dadin:
eta kloroargirita (AgCl) meatan ere agertzen da.
Argentitatik zilarra lortzeko sodio zianuroarekin erreakzionarazten da eta zinka gehitzen zaio zilar metalikoa hauspea dadin:
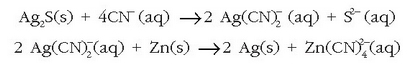
Zilarra zergatik belzten da airearekin nahastuta dagoenean? Eguratseko hidrogeno sulfurozko hondarrek zilarrarekin erreakzionatzen dute eta zilar sulfurozko geruza beltza sortzen dute horrela:
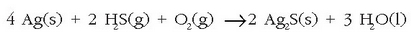
Antzera gertatzen da batzuetan zilarrezko koilarak edo sardeak zenbait jakirekin erabiltzen direnean; jaki horien proteina batzuek (adibidez arraultzarenak) sufrea dutelako gertatzen da hori.
Zilarra eta kobrea ez dira disolbatzen azido klorhidriko edo sulfuriko urtuetan, baina zilarrak azido nitriko urtuarekin erreakzionatuz zilar nitratoa ematen du. Hauxe da zilarraren konposaturik ugariena.
Zilar katioia 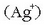 duen ur disoluzio bati kloruro, bromuro edo ioduro ioiak gehituz gero, dagokion zilar haluro disolbaezina (AgCl, AgI, AgBr)
hauspeatuko da; zilar kloruroa zuria da, zilar bromuroa hori argia eta zilar ioduroa hori bizia. Zilar haluro hauek argitan daudenean
pixkana-pixkana belztu egiten dira, deskonposatze fotokimiko honen ondorioz:
duen ur disoluzio bati kloruro, bromuro edo ioduro ioiak gehituz gero, dagokion zilar haluro disolbaezina (AgCl, AgI, AgBr)
hauspeatuko da; zilar kloruroa zuria da, zilar bromuroa hori argia eta zilar ioduroa hori bizia. Zilar haluro hauek argitan daudenean
pixkana-pixkana belztu egiten dira, deskonposatze fotokimiko honen ondorioz:
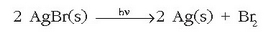
Erreakzio hori da, hain zuzen, argazkiak ateratzeko xafla edo filmetan erabiltzen dena. EEBBetan erabiltzen den zilarraren %30a, esaterako, argazkigintzan erabiltzen da.
Urrearen erreaktibotasuna oso apala da eta bere konposatu gehienak erraz erreduzitu edo deskonposa daitezke berriz ere urre askea lortzeko. Ez du ez oxigenoarekin, ez azido arruntekin erreakziorik ematen. Urrea azido nitriko eta klorhidriko kontzentratuen nahaste batean (aqua regia) disolbatzen da.
Kobrearen propietaterik ezagunena, behar bada, bere eroankortasun elektriko handia da
(zilarrak bakarrik dauka eroamen handiagoa). Gainera erraz harilka daitekeenez oso erabilia da kable elektrikoak egiteko. Kobrea lortzeko
iturririk nagusienak kalkozita 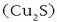 , kalkopirita
, kalkopirita
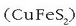 , kuprita
, kuprita 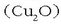 eta malakita
eta malakita 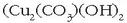 meak dira.
meak dira.
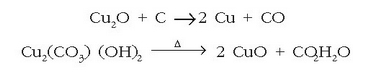
Sulfuroen kasuan metodorik ezagunena
txigorketa da, hau da, airearekin batera asko berotzea. Horrela sufrea sufre dioxido moduan askatuko da; gai hori da euri
azidoaren iturrietako bat da. Kobre sulfuroen kasuan txigorketa bi urratsetan egiten da. Lehenengoan aire kantitatea murriztu
egiten eta burdina FeO bihurtzen den bitartean kobrea oraindik 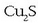 kobre sulfuro moduan gelditzen da. Sulfuro hau bereizi ondoren oxigeno gehiago pasarazten da eta kobre metalikoa lortzen da.
kobre sulfuro moduan gelditzen da. Sulfuro hau bereizi ondoren oxigeno gehiago pasarazten da eta kobre metalikoa lortzen da.
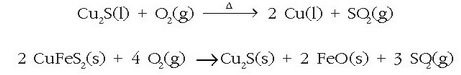
Horrela lorturiko kobrea elektrolisiz purifikatzen da
eroale elektrikoetan oso garbia behar baita. Kobrearen oxidazio egoerak +1 eta +2 dira. Kobre (II)-ren gatzik arruntena kobre
sulfatoa da 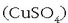 . Kobre (II) oxidoa (CuO) azido sulfurikozko
ur disoluzio batean disolbatutakoan kobre (II) sulfatoa lor daiteke. Kristal handiak, urdinak ikusten dira, hauek kobre (II) sulfato
pentahidratatuarenak dira
. Kobre (II) oxidoa (CuO) azido sulfurikozko
ur disoluzio batean disolbatutakoan kobre (II) sulfatoa lor daiteke. Kristal handiak, urdinak ikusten dira, hauek kobre (II) sulfato
pentahidratatuarenak dira 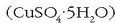 . Kristal hauek berotuz
. Kristal hauek berotuz
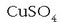 lortzen da (zuria). Konposatu hau zenbait disolbatzailek
(etanola, eterra) ur hondarrak dauzkaten jakiteko erabili ohi da:
lortzen da (zuria). Konposatu hau zenbait disolbatzailek
(etanola, eterra) ur hondarrak dauzkaten jakiteko erabili ohi da: 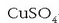 -zko
kristalak disolbatzaile horiei erantsitakoan, urik baldin badago sulfato hidratatua formatuko da eta kolore urdina berehala ikusiko da.
-zko
kristalak disolbatzaile horiei erantsitakoan, urik baldin badago sulfato hidratatua formatuko da eta kolore urdina berehala ikusiko da.