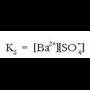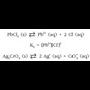Fisika-Kimika»Fisika - Kimika
Hauspeatze-erreakzioak
Disolbagarritasuna eta gatzen hauspeaketa
Analisi kimiko asko, bai kuantitatiboak bai kualitatiboak, gatzen hauspeaketak sorraraziz burutzen dira. Noiz sortuko da, ordea, hauspeatua? Gatzik geratuko ote da disolbatuta? Zenbat?
Gatz gehienak disolbagarriak dira uretan eta kantitate handietan gainera; baina badaude beste asko ere disolbagarritasun txikikoak. Hauei disolbaezinak esaten zaie.
Uretan disolbatzerakoan gatzei beren kristal-sarea deusezten zaie. Hori gerta dadin, ioien artean dauden erakarpen-indarrak gainditu behar dira eta hautsi, hau da, gatzaren sare-energia gainditu behar da. Hau lortzeko ioiak hidratatu egin behar dira disolbatzaile egoki baten bitartez. Jeneralean hidratatze-energia txikiagoa izan ohi da sare-energia baino; beraz, horren ondorioz, disolbatze-prozesuak endotermikoak izan ohi dira. Hortik dator, hain zuzen, ia gatz guztien disolbagarritasuna handiagoa egitea tenperatura igotzerakoan.
Disolbatze-prozesuan, bestalde, desordena handiagoa egiten da, hau da, entropia handiagoa egiten da, honekin disolbatze-prozesua erraztuz. Askotan bezala prozesuaren berezkotasunean eragina duten bi terminoak bata bestearen kontrakoak dira: termino entalpikoa (energia) eta termino entropikoa (ordena). Hortik dator tenperatura bakoitzean disolbagarritasun-oreka konkretu bat egotea.
Kantitate gutxitan disolbatzen diren gatzek jeneralean, sare-energia handiagoak dituzte asko disolbatzen diren gatzek baino, baina hidratazio-energia txikiagoak. Disolbatze-prozesua, horregatik, kasu horietan zail eta oso poliki gertatu ohi da. Honela bada, ioi disolbatuen kontzentrazioa oraindik ere oso txikia denean, ioiak kristalizatzen hasten dira abiadura batean. nahiz hau oso txikia izan. Abiadura hori nahikoa da, hala ere, disolbatze-abiadura berdintzeko, hau, gorago esandakoagatik, oso txikia baita. Orekara iritsitakoan disoluzioa asetu egin dela esan ohi da.
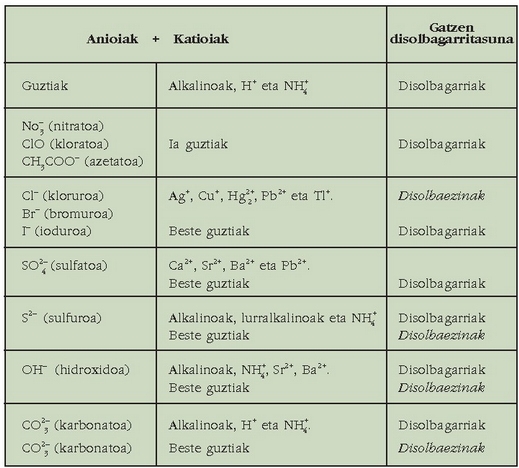
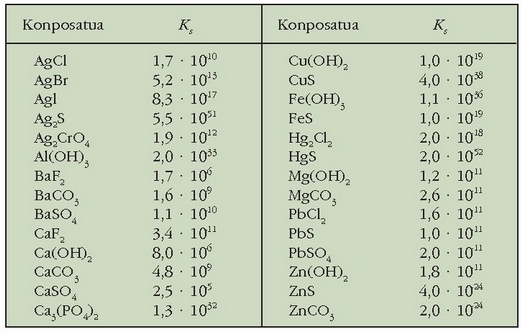
Ez da batere erraza gatzen disolbarritasuna aurresatea. Taulan zenbait konposatu ionikoren disolbagarritasuna ikus daiteke kualitatiboki emanda.
Bi disoluzio nahastutakoan, bakoitzak gatz disolbaezinaren ioi banarekin,
gatzaren hauspeaketa gertatzen da normalean. Hala, adibidez, bario klorurozko
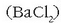 disoluzio bati potasio sulfatozko
disoluzio bati potasio sulfatozko 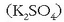 beste disoluzio bat botatzen bazaio, bario sulfatozko
beste disoluzio bat botatzen bazaio, bario sulfatozko
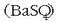 hauspeatu zuria eratzen da, erreakzio honen arabera:
hauspeatu zuria eratzen da, erreakzio honen arabera:
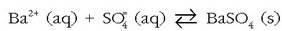
Potasio ioiak 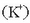 eta kloruroak
eta kloruroak 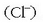 zeuden moduan geratu dira, erreakzionatu gabe.
zeuden moduan geratu dira, erreakzionatu gabe.
Disolbagarritasun-biderkadura
Ez dago gatzik, zehatz esanda, disolbaezina denik. Gutxien disolbatzen diren gatzen kasuan ere beti dago oreka disolbatu gabeko gatz solidoaren eta disoluziotan dauden ioien artean. Goragoko kasuan adibidez hauxe edukiko dugu:
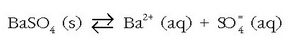
Disolbaezin esaten zaien gatzen kasuan oreka hau ezkerreko aldera dago desplazatuta, baina beti daude
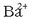 eta
eta
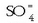 ioien kontzentrazioak,
txikiak badira ere, disoluziotan, oreka kimikoaren legea behar dutenak:
ioien kontzentrazioak,
txikiak badira ere, disoluziotan, oreka kimikoaren legea behar dutenak:
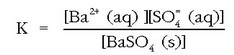
Disolbatu gabeko gatza solido purua denez, dagokion kontzentrazioaren balioa konstantea da tenperatura eta presio jakinetan (laboratorioko baldintza normalak). Beraz honelaxe idatz daiteke oreka-baldintza:
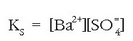
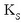 gatzaren disolbagarritasun-biderkadura
deritzona da.
gatzaren disolbagarritasun-biderkadura
deritzona da.
Oreka dagoenean, beraz, disolbatu gabeko solidoaren eta disoluziotan dauden ioien artean berdintza hori betetzen da.
Zer gertatuko litzateke noizpait horrela ez balitz eta beste adierazpen hau beteko balitz:
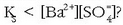
Bi gauza esan daitezke horretaz:
1. Sistema horretan ez dago orekarik.
2. Disoluzioa ez dago asetuta eta ez da solidorik egongo hauspeatuta.
Zer geratatuko litzateke, ordea, hau beteko balitz:
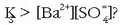
Berriz ere bi gauza ditugu:
1. Berriz ere ez da orekarik izango.
2. Nola disoluziotan dauden ioien kontzentrazioen biderkadura handiagoa den orekazko biderkadura baino,
hauspeaketa (solidoaren eraketa) gertatuko beharko da orekara iristeko, ioien kontzentrazioak txikiagoak eginez.
Orekara iritsitakoan berdintza beteko da:
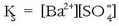
Jeneralean, bada, bi disoluzio baditugu bata bario klorurozkoa
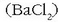 eta bestea potasio sulfatozkoa
eta bestea potasio sulfatozkoa 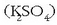 eta nahasten baditugu, nahastu ondoren
eta nahasten baditugu, nahastu ondoren
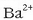 ioien kontzentrazioa
ioien kontzentrazioa 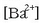 izanik eta
izanik eta 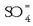 ioien kontzentrazioa
ioien kontzentrazioa
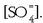 . Bi gauza hauek gerta daitezke:
. Bi gauza hauek gerta daitezke:
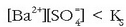 Kasu honetan ez da hauspeaturik eratuko.
Kasu honetan ez da hauspeaturik eratuko.
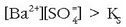 Hauspeatua eratuko da.
Hauspeatua eratuko da.
Gatzak bi ioi baino gehiago ematen dituenean disolbatzerakoan, gatz horren disolbagarritasun-biderkadura
idazterakoan ioi-kopurua ere kontuan hartu behar da, kontzentrazioan berretzaile jarrita.
Adibidez, bario fluoruroak 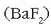 ioi hauek ematen ditu disolbatzerakoan:
ioi hauek ematen ditu disolbatzerakoan:
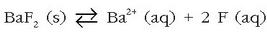
Dagokion disolbagarritasun-biderkadura hauxe izango da:
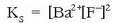
Disolbagarritasun-biderkadura tenperaturaren menpe dagoen magnitudea da eta normalean 25ºC-tan eman ohi da. Taulan zenbait gatzen disolbagarritasun-biderkadurak ikus daitezke.
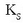 txikia denean ioien
kontzentrazioa disoluziotan txikia dela esan nahi du eta disolbagarritasuna ere txikia izango da.
txikia denean ioien
kontzentrazioa disoluziotan txikia dela esan nahi du eta disolbagarritasuna ere txikia izango da.
Hona hemen zenbait gatzen disolbatze-oreka eta disolbagarritasunbiderkaduraren adierazpena:
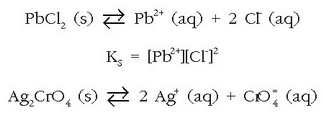
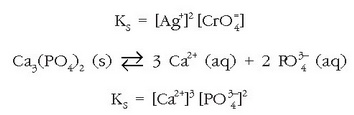
Zilar kloruroaren disolbagarritasun-biderkadura, ezaguna da,
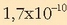 -ekoa da 25ºC-tan.
Jakin nahi da hauspeaturik eratuko den 0,1 M den
-ekoa da 25ºC-tan.
Jakin nahi da hauspeaturik eratuko den 0,1 M den
 -zko 1l disoluzio eta 0,1 M
den HCl-zko 1l disoluzio nahastutakoan.
-zko 1l disoluzio eta 0,1 M
den HCl-zko 1l disoluzio nahastutakoan.
Zilar kloruroaren disolbatze-oreka hauxe da:
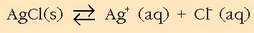
Disolbagarritasun-biderkadura hauxe da:
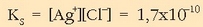
Disoluzioak nahastutakoan bolumena 2 l-koa izango da eta ioien kontzentrazioak hauexek:
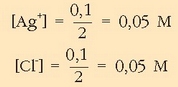
Biderkatuz:
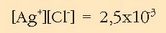
Ikusten den bezala: 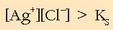
Beraz hauspeatua eratuko da.
Kaltzio bromuroaren disolbagarritasuna uretan
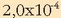 mol/lkoa da 25ºC-tan.
Bere disolbagarritasun-biderkadura jakin nahi da. Kaltzio bromuroaren disolbatze-oreka hauxe dela jakinik:
mol/lkoa da 25ºC-tan.
Bere disolbagarritasun-biderkadura jakin nahi da. Kaltzio bromuroaren disolbatze-oreka hauxe dela jakinik:
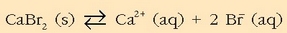
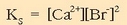
Disolbatze-orekan ikusten den bezala,  bakoitzeko 1mol
bakoitzeko 1mol 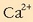 eta 2 mol
eta 2 mol
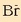 eratzen dira.
Nola
eratzen dira.
Nola 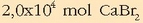 disolbatzen diren litro bakoitzeko,
ioien kontzentrazioak hauexek izango dira:
disolbatzen diren litro bakoitzeko,
ioien kontzentrazioak hauexek izango dira:
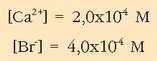
Ordezkatu besterik ez dago disolbagarritasun-biderkadura lortzeko:
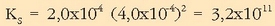
Ioi komunaren efektua
Gutxi disolbatzen den gatza ur purutan disolbatzen bada, bere ioien kontzentrazioa
gatzaren disoziazioaren ondorioz sortuko da, ez besterik.
Hala, 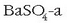 ur purutan disolbatzen bada:
ur purutan disolbatzen bada:
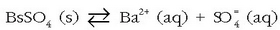
Nahi eta nahi ez hau bere behar da:
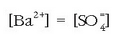
Baita hau ere, disoluzio asetuta badago:
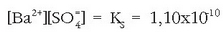
Beraz:
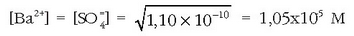
Ikus dezagun zer gertatzen den disoluzio horri konposatu disolbagarria botatzen badiogu,
ioi komuna duena  -arekin.
Hauek izan daitezke, adibide, konposatu disolbagarri horiek:
-arekin.
Hauek izan daitezke, adibide, konposatu disolbagarri horiek:
 Argi dago:
Argi dago:
 -aren balioa
handiagoa egingo da eta Le Chatelier-en hastapenaren arabera disolbatze-oreka ezkerreko aldera abiatuko da.
-aren balioa
handiagoa egingo da eta Le Chatelier-en hastapenaren arabera disolbatze-oreka ezkerreko aldera abiatuko da.
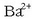 ioien kontzentrazioa jaitsiz,
ioien kontzentrazioa jaitsiz,
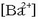 balioaren jaistea erraz
kalkula daiteke, kontuan hartuz
balioaren jaistea erraz
kalkula daiteke, kontuan hartuz 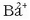 ioien eta
ioien eta 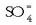 ioien biderkadurak
konstante mantendu behar dela.
ioien biderkadurak
konstante mantendu behar dela.
Ioi komunaren eragina sarri erabili ohi da Kimikan ioi konkretu baten
hauspeaketa oso-osorik burutzeko; horretarako hauspeatzailea botatzen da kantitate handietan. Disoluzio bateko
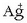 ioia hauspeatu nahi bada
oso-osorik AgCl eran, NaCl-a botako da disoluziotara kantitate handietan; disoluziotan ez da ia-ia
ioia hauspeatu nahi bada
oso-osorik AgCl eran, NaCl-a botako da disoluziotara kantitate handietan; disoluziotan ez da ia-ia
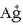 ioirik geratuko.
ioirik geratuko.
AgCl-aren disolbagarritasun-biderkadura
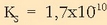 -ekoa da 25ºC-tan.
Jakin nahi da zein izango den
-ekoa da 25ºC-tan.
Jakin nahi da zein izango den 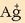 ioien kontzentrazioa AgCl-a, asetu arte, ur purutan disolbatzen bada. Zein izango litzatekeen, hau ere jakin nahi da,
ioien kontzentrazioa AgCl-a, asetu arte, ur purutan disolbatzen bada. Zein izango litzatekeen, hau ere jakin nahi da,
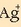 ioien kontzentrazioa AgCla, asetu arte,
0,1 M den NaCl-zko disoluziotan disolbatuko balitz.
ioien kontzentrazioa AgCla, asetu arte,
0,1 M den NaCl-zko disoluziotan disolbatuko balitz.
Ur purutan disolbatzen den kasurako bi baldintza daude bete beharrekoak:
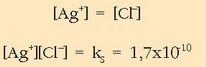
Beraz, emaitza erraza da:
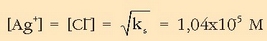
Horixe da 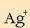 ioien kontzentrazioa.
ioien kontzentrazioa.
0,1 M den NaCl-zko disoluziotan disolbatutakoan hauxe edukiko dugu:
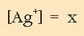 Ezezaguna da ioi horren kontzentrazioa.
Ezezaguna da ioi horren kontzentrazioa.
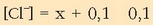 Ioi honek bi kontribuzio ditu,
AgCl-arena (x) eta NaCl-arena (0,1). Hurbilketa bat egin da, logikoa, gatz disolbaezinaren kontribuzioa oso txikia delako.
Ioi honek bi kontribuzio ditu,
AgCl-arena (x) eta NaCl-arena (0,1). Hurbilketa bat egin da, logikoa, gatz disolbaezinaren kontribuzioa oso txikia delako.
Ordezkatuz disolbagarritasun-biderkaduaren adierazpenean:
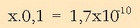
Erraz dugu 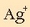 ioien kontzentrazioa:
ioien kontzentrazioa:
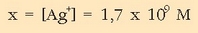
Ikusten den bezala ia-ia ez da zilar klorurorik geratzen disolbatuta.
HAUSPEATZE ERRAKZIOAK
NaCl-zko ur-disoluzio bati 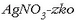 ur-disoluzioa botatakoan, AgClzko hauspeatu gorria eratzen da.
ur-disoluzioa botatakoan, AgClzko hauspeatu gorria eratzen da.
NaI-zko ur-disoluzio bati
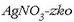 ur-disoluzioa botatakoan,
AgI-zko hauspeatu hori hila eratzen da.
ur-disoluzioa botatakoan,
AgI-zko hauspeatu hori hila eratzen da.
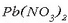 -zko
ur-disoluzio bati NaI-zko ur disoluzioa botatakoan,
-zko
ur-disoluzio bati NaI-zko ur disoluzioa botatakoan,
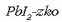 hauspeatu horia eratzen da.
hauspeatu horia eratzen da.