Fisika-Kimika»Fisika - Kimika
Oreka kimikoa
Orekaren izaera
Prozesu kimikoak, fisikoak bezala, itzulgarriak dira, hau da, sortutako produktuak gai dira, neurri batean behintzat, hasierako substantziak emateko. Eratzen den produktu kantitatea eta erreaktiboak emateko desagertzen den kantitatea berdinak direnean, erreakzioa oreka egoerara iritsi dela esaten da.
Adibide bat argigarri izando da. Ur-lurrina eta burdin zatiak berotuz gero, temperatura konstantean, hodi itxi batean gaiok erreakzionatzen hasiko dira; fase solidoan burdinaren zati bat erdoildu egingo da, oxidoa eratuz; gas fasean, berriz, erreakzioan sortutako hidrogenoa edukiko dugu, eta hidrogeno kontzentrazioa geroz eta handiagoa izango da ur-lurrinarena txikiagoa egiten den bitartean.
Orduan, ordea, hidrogenoak oxidoarekin erreakzionatuko du, berriro burdina eta ur-lurrina emateko, alderantzizko erreakzioan ikus daitekeen bezala. Hau da:
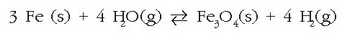
Alderantziz gertatzen diren erreakzioen lastertasunak berdinak izango dira oreka puntuan, orduan lau gaiak batera egongo dira hodiaren barruan eta duten kontzentrazioari eutsiko diote hortik aurrera. Oreka egoera lortu dela esango dugu.
Prozesu fisikoak bezala, hauek ere prozesu dinamikoak dira, hau da, prozesu mikroskopikoek ez dira aldatzen.
Beti horrela ote da? Lor ote daiteke modu batera edo bestera, burdina guztia oxidatzea?
Helburua, hodi ireki batean erreakzioa burutuz lortuko litzateke, hodiaren alde batetik ura sartuz eta bestetik irteera emanez. Aerago, behin burdina guztia oxido bihurtu ondoren, hidrogenoa sartuko bagenu tenperatura berean hodi barruan, alderantzizko erreakzioa gertatuko litzateke eta oxido guztia, berriz ere, burdina bihurtuko litzateke.
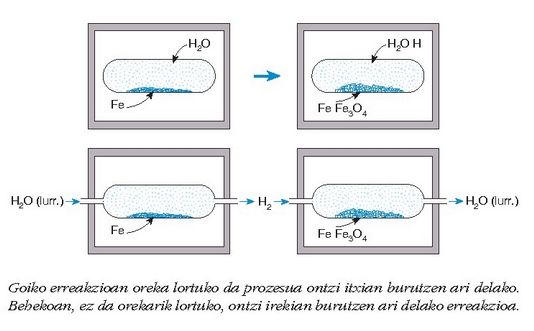
Edozein erreakzio, beraz, oso-osorik burutu daiteke, erreakzioan sortutako produktuak, sortu ahala, sistema erreakzionatzailetik kenduz; bestela alderantzizko erreakzioa eragingo baita.
Beraz, sistema itxian baizik ezin daiteke gertatu oreka egoera, sistema hori baita erreakzioan parte hartzen duten gaien arteko kontaktua ahalbidetzen duen egoera bakarra.
Garrantzi handikoa da orekan dauden sistemak eta sasi-orekan daudenak bereiztea ; hauek, eskuarki, orekatik urrun daude baina, oso lastertasun edo abiadura txikikoak direnez, orekan daudela dirudite, gaien kontzentrazioak ia-ia aldatzen ez direlako.
Oreka kimikoaren legea
Erreakzio batean oreka lortzen denean, bertan parte hartzen duten gai guztiak erreakzio ontzian daude, baina zein kantitatean? zein da gai horien arteko erlazioa, erlaziorik baldin badago?
Adibide xume batekin aztertuko da arazoa: hidrogeno ioduroaren eraketa edo deskonposizioa. Ondorengo erreakzioren bidez adierazten da:
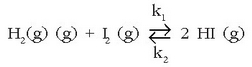
Masa ekintzaren legea erreakzio biei aplikatuta, zuzenari eta alderantzizkoari, bi prozesuei dagozkien lastertasunak lortuko dira:
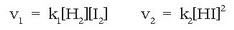
Lastertasun hauek aldatuz doaz prozesuan zehar; hasieran, adibidez, alderantzizko erreakzioaren lastertasuna zero izango da,
artean ez baitago produkturik  ;
erreakzio zuzenaren lastertasuna berriz, hadiena izangoa da, nola hidrogenoaren hala iodoaren kontzentrazioak handienak direlako.
Beste edozein unetan txikiagoa izango da erreakzio zuzenaren lastertasuna (iodoaren eta hidrogenoaren kontzentrazioak txikiagoak dira),
baina handiagoa alderantzikoarena, jada ez baita zero produktuaren kontzentrazioa.
;
erreakzio zuzenaren lastertasuna berriz, hadiena izangoa da, nola hidrogenoaren hala iodoaren kontzentrazioak handienak direlako.
Beste edozein unetan txikiagoa izango da erreakzio zuzenaren lastertasuna (iodoaren eta hidrogenoaren kontzentrazioak txikiagoak dira),
baina handiagoa alderantzikoarena, jada ez baita zero produktuaren kontzentrazioa.
Oreka egoerara iritsitakoan begibistakoa da lastertasun biak berdinak izango direla. Beraz hauxe beteko da:

Honela ere idatz daiteke:
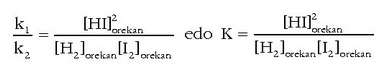
Ekuazio honi oreka kimikoaren legea edo masa ekintzaren legea esaten zaio eta Gulberg-ek eta Waag-ek lortu zuten.
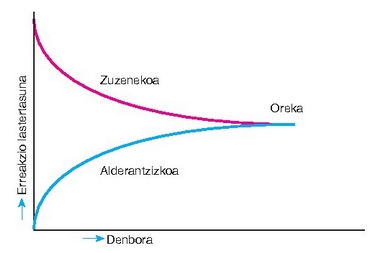
Orekan erreakzio-abiadurak, zuzena eta alderazntzizkoa, biak berdinak dira. Orekara iritsi aurretik ez da horrela.
Nola lastertasun konstantean, 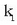 eta
eta
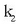 , ez diren kontzentrazioaren funtzio,
baizik eta tenperaturaren funtzio soilak, beste horrenbeste esan daiteke (K) oreka-konstantea esaten zaion beste konstanteaz.
Hori ere tenperaturaren funtzioa izango da, ez besterik.
, ez diren kontzentrazioaren funtzio,
baizik eta tenperaturaren funtzio soilak, beste horrenbeste esan daiteke (K) oreka-konstantea esaten zaion beste konstanteaz.
Hori ere tenperaturaren funtzioa izango da, ez besterik.
Oreka-konstantean ageri diren kontzentrazioak ez dira edozein kontzentrazio, orekazko kontzentrazioak baizik, oreka posible egin dutenak, alegia. Horregatik idatzi da «oreka» azpindizea, hori esan nahian, baina normalean ez da idazten.
Ondoren, HI-aren lorpenaren gainean zenbait esperientziaren orekazko balioak idazten dira, erabilitako hasierako kontzentrazioekin batera.
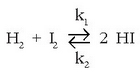 orekari dagozkion zenbait emaitza.
orekari dagozkion zenbait emaitza.
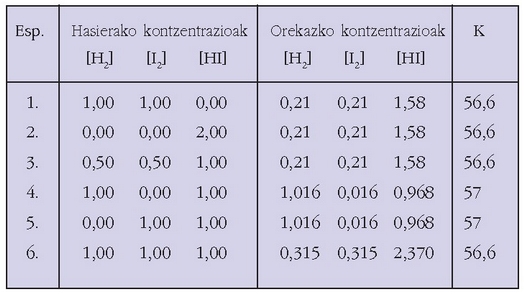
Ikusten den bezala oreka-konstantea beti berdina da, zeinahi izan hasierako erreaktiboen eta produktuen kontzentrazioak.
30 g azido azetiko
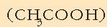 46 g etil alkoholekin
46 g etil alkoholekin
 erreakzionarazten direnean,
erreakzioa bukatutakoan 36,96 g etil azetato
erreakzionarazten direnean,
erreakzioa bukatutakoan 36,96 g etil azetato 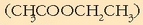 eta ur kantitate bat eratu direla ikusiko da. Esterifikatzea esaten zaion erreakzio honen oreka-konstantea kalkulatuko
dugu eta eratu den ur kantitatea.
eta ur kantitate bat eratu direla ikusiko da. Esterifikatzea esaten zaion erreakzio honen oreka-konstantea kalkulatuko
dugu eta eratu den ur kantitatea.
Erreakzio kimikoez ari garenean kantitatea moletan hartzea komeni da. Azido azetikoaren, etil alkoholaren eta etil azetatoaren pisu molekularrak 60, 46 eta 88 direla kontutan hartuta, mol kantitateak hauexek izango dira: 0,5 mol azido azetiko, 1,0 mol etil alkohol eta 0,42 mol etil azetato.
Gauzak argiago ikusteko erreakzioa idaztea komeni da hasierako kantitateekin batera:
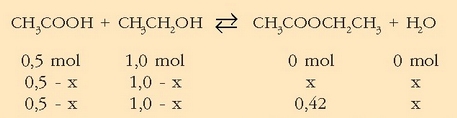
Bigarren lerroan orekan izango diren kantitateak ikus daitezke. Emaitza logikoa da erreakzioko estekiometria koefizienteei begiratuta, azido azetikozko mol bakoitzeko, mol bat etil alkohol gastatzen baita, eta mol bana etil azetato eta ur eratzen dira. Hirugarren lerroan ezagutzen den etil azetato kantitatea jarri da. Esandakoagatik garbi geratzen da, gai bakoitzetik zer kantitate dagoen orekan: 0,5-0,42 mol azido azetiko, 1,0-0,42 mol etil alkohol, 0,42 mol etil azetato eta 0,42 mol ur. Disoluzio osoaren bolumena V izanik, erraz kalkula daitezke gaien orekazko kontzentrazioak:
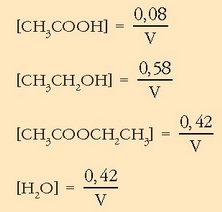
Oreka-konstantea lortzeko dagokion adierazpenean ordezkatu baino ez dago:
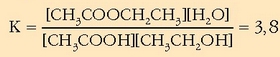
Oreka-konstantea
Erreakzio kimiko bakoitzak bere oreka-konstante berezia du, eta, esan den bezala, tenperaturaren arabera aldatzen da,
oreka-konstantea ematen duten lastertasun-konstanteak ere, 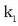 eta
eta 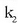 , tenperaturarekin aldatzen direlako.
, tenperaturarekin aldatzen direlako.
Oreka-konstantearen adierazpenean erreaktiboen kontzentrazioak zatitzailean eta produktuenak zatikizunean daudela kontuan hartuta, atera daitekeen ondorioa garbia da, alegia, oreka-konstantea handia denean, handiak izango dira produktuen kontzentrazioak (ala txikiak erreaktiboen kontzentrazioak) eta, alderantziz, orekakonstantea txikia denean, produktuen kontzentrazioak txikiak direlako izango da (ala handiak erreaktiboen kontzentrazioak).
Oreka-konstantea, sarritan, erreakzioan parte
hartzen duten gaien kontzentrazio molarrak jarriz adierazten da, baina ez da modu bakarra; substantziak gas egoeran daudenean,
presio partzialak erabil daitezke, edo -hala nahi edo komeni bada, produktak zeinahi egoeratan daudela- zatiki molarrak ere bai.
Horren arabera, azpindize desberdinak jartzen zaizkio oreka-konstanteari:
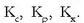
Adibide honetan: 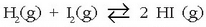 produktu guztiak gas egoeran daude eta presio partzialak erabiltzen badira oreka-konstantea adierazteko,
horrelaxe geratuko da oreka-konstantearen adierazpena:
produktu guztiak gas egoeran daude eta presio partzialak erabiltzen badira oreka-konstantea adierazteko,
horrelaxe geratuko da oreka-konstantearen adierazpena:
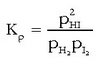
Beste askotan, gehienetan, benetako oreka-konstantea -inoiz orekazko konstante termodinamikoa ere deritzona-,
erreakzioan parte hartzen duten gaien aktibitatearen funtzioan jartzen da eta oreka-konstantea «a» azpindizearekin adierazten:
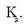
Oreka kimikoaren legea erabilpen handiko legea da eta erreakzio kimiko askotan erabil daiteke: azido edo base ahulen disoziazioan, azido-base oreka erreakzioetan, disolbagarritasun-konstantea ere oreka-konstantea da, oxidazio-erredukzio orekak ere lege horren bitartez adieraz daitezke, e.a.
Nitrogeno dioxidoa sartzen bada 5 litroko ontzi batean, 1 atmko presiopean eta 327 ° C-tan, gai horren disoziazioa gertatzen da, erreakzio honen arabera:
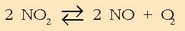
Behin oreka lortuta, ontzia hozten bada erreakzioa gerarazteko eta analisia egin, ondorengoa dagoela ikusiko da:
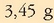 ,
, 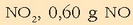 eta
eta 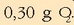
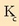 eta
eta
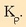
Honelako ariketetan substantzia kantitateak moletan ematea izaten da egokiena.
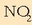 -aren, NO-aren eta oxigenoaren pisu
molekularrak 46, 30 eta 36 direla kontuan hartuta, hauxek dira gaien mol kopuruak:
-aren, NO-aren eta oxigenoaren pisu
molekularrak 46, 30 eta 36 direla kontuan hartuta, hauxek dira gaien mol kopuruak:
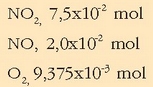
Kontzentrazioa erraz atera daiteke bolumena ezaguna delako, 5 litro, alegia.
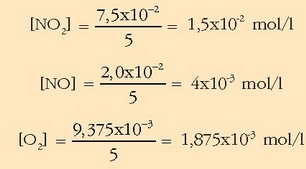
Balio hauekin  kalkulatuko da:
kalkulatuko da:
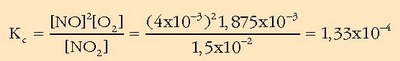
Balioa hain txikia denean oreka ezker aldera desplazatuta dagoela esan nahi du.
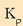 kalkulatzeko hiru gaien presio partzialak kalkulatu behar dira, era idealean portatzen direla ziurtzat emanda beti ere,
hau da, gas idealen ekuazioa betetzen dutela:
kalkulatzeko hiru gaien presio partzialak kalkulatu behar dira, era idealean portatzen direla ziurtzat emanda beti ere,
hau da, gas idealen ekuazioa betetzen dutela: 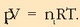
Beraz,
 -arentzat:
-arentzat:
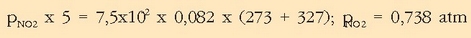
Berdin kalkulatzen dira beste bien presio partzialak:

Oreka-konstantea, beraz:
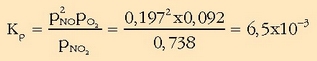
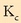 kalkulatuta,
bazegoen beste modu bat errazagoa,
kalkulatuta,
bazegoen beste modu bat errazagoa, 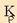 lortzeko,
biak ondorengo adierazpenaren bitartez erlazionatuta baitaude:
lortzeko,
biak ondorengo adierazpenaren bitartez erlazionatuta baitaude:
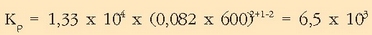
Oreka heterogeneoa
Oreka heterogeneoetan solido edo isurkari puruak daude gasekin batera. Ikustekoa da nola erabiltzen den horrelako oreketan oreka legea.
Ur-lurrinak eragindako burdinaren oxidazioaren erreakzioa, oreka heterogeneoaren adibidea da:
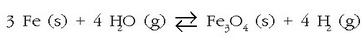
Oreka-konstantearen adierazpena idatzi aurretik, erreakzioan ageri diren gaien esanahia eta egoera
jakin beharra dago. Alde batetik gas-nahastea dugu, hidrogenoak eta ur-lurrinak osatua; egoera solidoan,
berriz, bi substantzia daude, Fe (s) eta 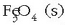 baina ez daude disoluzio egoeran; beraz, puruak direla esan daiteke.
Substantzia puruen kontzentrazioaren definizioa, disoluzioena bezala, ezaguna da: bolumen unitateko
dagoen mol kopurua. Substantzia puruen kasuan, dentsitatea bider pisu molekularra. Biak gaien ezaugarriak
dira eta ez dute zer ikusirik erreakzioarekin. Horregatik substantzia puruen kontzentrazioak erreakzio
kimikoetan konstantetzat jotzen dira eta oreka-konstantearen barruan sartu, formulan adierazten den bezala:
baina ez daude disoluzio egoeran; beraz, puruak direla esan daiteke.
Substantzia puruen kontzentrazioaren definizioa, disoluzioena bezala, ezaguna da: bolumen unitateko
dagoen mol kopurua. Substantzia puruen kasuan, dentsitatea bider pisu molekularra. Biak gaien ezaugarriak
dira eta ez dute zer ikusirik erreakzioarekin. Horregatik substantzia puruen kontzentrazioak erreakzio
kimikoetan konstantetzat jotzen dira eta oreka-konstantearen barruan sartu, formulan adierazten den bezala:
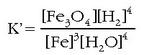
Konstanteak ezkerretara pasatuz:
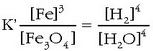
Eta bukatzeko:
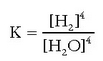
Horra erreakzio heterogeneoari dagokion oreka-konstantea.
Adierazpen horren arabera, oreka heterogeneoetako oreka-konstantean ez dira ageri solidoen edo isurkarien kontzentrazioak; bai, ordea, gasenak.
Adibide interesgarria H2S-aren sintesiak ematen du, bere orekakonstantearen adierazpena desberdina baita, prozesua burutzen den tenperaturaren arabera:
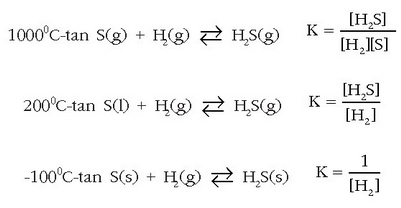
Orekan eragina duten faktoreak
Orekan eragina duten faktoreak tenperatura, presioa eta erreakzioan parte hartzen duten gaien kontzentrazioak dira.
Orekan dagoen erreakzio batean, horietako faktore bat aldatzen bada, oreka desegin egiten da. Orduan erreakzioa alde batera ala bestera abiatuko da, berriz ere orekara iritsi arte. Zalantzarik gabe, lortuko den oreka berria ez da izango aurrekoaren berdina, gaien kontzentrazioak desberdinak izango baitira.
Faktore baten aldaketaren aurrean, erreakzioak nola jokatuko duen iragartzeko, Le Chatelier-en printzipioa erabil daiteke:
Orekan dagoen sistema bati faktoreren bat aldatzen bazaio (tenperatura, presioa edo kontzentrazioa), orekaren joera aldatze-prozesu horren aurka joatea izango da.
Adibideekin ikusiko da argiago printzipio hau.
a) Tenperaturaren eragina
Orekan dagoen ondorengo erreakzioa hartuko da:
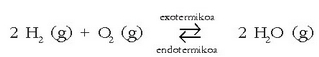
Erreakzioa eskuin aldera abiatzen denean exotermikoa da, eta endotermikoa ezker aldera abiatzerakoan. Sistema hozten bada (tenperatura jaitsi), Le Chaterlier-en printzipioaren arabera, erreakzioa eskuin aldera abiatuko da, beroa emanez. Sistema berotzen bada, ostera, erreakzioak hozteko joera edukiko du, ezker aldera abiatuko da.
b) Presioaren eragina
Presioaren eragina txikia da gehienetan, gasen arteko erreakzioetan edo gasen batek parte hartzen duen erreakzioetan izan ezik. Adibide batekin erraz ulertuko da:
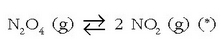
Eskuin aldeko gaiek presio handiagoa egiten dute ezker aldekoek baino, gasak idealak izanda, mol kopuru handiagoari presio handiagoa dagokiolako. Beraz presio handitzea gertatuko da erreakzioa eskuin aldera abiatzen bada, eta alderantziz. Presioa handitzen bada kanpoko eragile baten eraginez, erreakzioak presioa jaisteko ahaleginak egingo ditu eta ezker aldera abiatuko da, hau da mol kopuru txikiena dagoen aldera. Mol kopuruan aldaketarik gertatzen ez den erreakzioetan, ondorioz, presioak ez du eraginik izango oreka egoeran.
c) Kontzentrazioaren eragina
Orekan parte hartzen duten gaien kontzentrazio aldaketek ez dute oreka-konstantearen balioa aldatzen, baina oreka-kontzentrazioak aldatzen dituzte.
Hidrogeno kloruroaren oxidazioa –kloroa emateko– aspalditik ezagutzen den erreakzioa da:
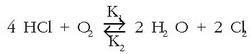
Erreakzio honen helburua kloroa lortzea denez, ahalegin guztiak erreakzioa eskuin aldera aldatzearen
aldekoak izango dira. Le Chatelier-en printzipioaren arabera, toki aldatzea bi modutara egin daiteke:
1) erreaktiboren baten kontzentrazioa handiagoa eginez (adibidean errazena
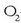 -aren kontzentrazioa
handitzea izango litzateke) edo 2) produktuetatik bat ezabatuz (ura edo kloroa). Normalean ura da ezabatzen dena,
eratzen den ur-lurrina zurgatuz.
-aren kontzentrazioa
handitzea izango litzateke) edo 2) produktuetatik bat ezabatuz (ura edo kloroa). Normalean ura da ezabatzen dena,
eratzen den ur-lurrina zurgatuz.
Berdin egin daiteke oreka-konstantearen adierazpena erabiliz:
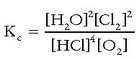
Oxigenoaren kontzentrazioa handitzen denean, adibidez, beharbeharrezkoa da, oreka-konstantea aldatu ez dadin, zenbatzailearen balioa handiagotzea; eta hori ura eta kloroa ekoiztuz lortuko da. Erreakzioa, beraz, eskuin aldera abiatuko da. Bigarren adibidean, eratzen den ura ezabatzen bada, txikiagoa egiten da zatikiaren zenbakitzailea; konstantea alda ez dadin, izendatzailea ere txikiagoa egin beharko da, hau da HCl-a eta oxigenoa gastatuko dira kloro gehiago emateko
LE CHATELIER-EN PRINTZIPIOA
Ezkerrean: Eskuineko ontzian 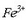 eta
eta 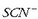 (tiozianato) ioiak dituen ur disoluzioa dago.
Bi ioiak orekan daude
(tiozianato) ioiak dituen ur disoluzioa dago.
Bi ioiak orekan daude 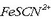 ioi gorri ilunarekin:
ioi gorri ilunarekin:
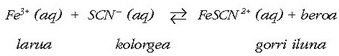
Horregatik ikusten da tarteko kolorea.
Eskuinetik hasi eta bigarren ontzian disoluzio bera dago, baina
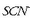 gehiagorekin.
Disoluzioa gorriago egin da
gehiagorekin.
Disoluzioa gorriago egin da 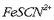 gehiago eratu delako, Le Chatelier-en printzipioaren arabera oreka eskuin aldera aldatu delako. Ezkerretik
hasi eta bigarren ontzian ere
gehiago eratu delako, Le Chatelier-en printzipioaren arabera oreka eskuin aldera aldatu delako. Ezkerretik
hasi eta bigarren ontzian ere 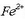 gehiago jarri da; oreka, aurrekoan bezala, eskuineko aldera aldatu da, eta disoluzioa gorritu egin da.
Azken ontzian zilar nitrato disoluzioaren kopuru txiki bat bota da. Honen eraginez AgSCN hauspeakin zuria eratzen da eta SCN -
ioiaren kontzentrazioa txikiagoa egin eta oreka ezkerreko aldera aldatu da; disoluzioak hasieran zuen kolore horixka galdu du.
gehiago jarri da; oreka, aurrekoan bezala, eskuineko aldera aldatu da, eta disoluzioa gorritu egin da.
Azken ontzian zilar nitrato disoluzioaren kopuru txiki bat bota da. Honen eraginez AgSCN hauspeakin zuria eratzen da eta SCN -
ioiaren kontzentrazioa txikiagoa egin eta oreka ezkerreko aldera aldatu da; disoluzioak hasieran zuen kolore horixka galdu du.
Eskuinean: Erreakzio honetan adierazten denez, prozesua exotermikoa da. Hozterakoan, beraz, erreakzioa eskuineko aldera aldatuko da, irudian ikus daitekeen bezala. Ezkerreko ontzia hoztean eskuineko aldera aldatu da oreka, eta disoluzioaren kolore horixka gorri bihurtu da.

AFINITATE KIMIKOA 1
Alkimistek ia-ia gizakienak diren ezaugarriak ematen zizkieten gai kimikoei, eta, hala, haien ustez, gaiek elkarrekiko maitasuna sentitzen zutenean gertatzen ziren erreakzioak. Robert Boylek, The Sceptical Chemyst obran (1661, “Kimikari eszeptikoa”), susmo txarrez begiratzen zituen teoria horiek:
“Adiskidetasuna eta areriotasuna izaki adimendunen gauzatzat ikusten ditut, eta oraindik ezin izan dit inork agertu nola egotz dakizkiekeen nahi horiek gorputz bizigabe eta ezagutzarik gabeei, eta, areago, zentzurik gabeko gorputzei.”
Urte horretan bertan, Isaac Newton Trinity College ikastetxean sartu zen, Cambridgen, hemeretzi urte zituela. Kimika esperimentuen oso zale izana zen beti, eta orduak eta orduak ematen zituen lorategiko laboratorioan, bere gelen atzealdean, Cambridgen.
“Oso gutxitan oheratzen zen goizaldeko ordu biak edo hirurak baino lehen, eta batzuetan bostak edo seiak arte ere geratzen zen… batez ere udaberrian eta udazkenean; udazkenean, sei bat aste eman ohi zituen bere laboratorioan, eta han, berak egiten zuelarik gau bateko beila eta nik bestea, ez egunez ez gauez ez zen ia sua itzaltzen, harik eta bere esperimentu kimikoak bukatzen ez zituen arte.”
Holaxe kontatzen zuen haren lehengusu eta laguntzaile izan zen Humphrey Newtonek.
Kimikako libururik inoiz argitaratu ez zuen arren, kimikari buruzko galdera garrantzitsuak egin zituen Newtonek Queries lanean (galderak), Optiks liburuaren amaieran. Dirudienez, gorputzen arteko grabitazio erakarpenaz egin zuen lanaren ondorioz, gai kimiko desberdinen arteko afinitatea beren atomoen edo zatikien erakarpen indarretik etor zitekeela pentsatu zuen. Gogoan izan behar da garai hartan ez zela oso argi ulertzen zein alde dagoen nahastura, disoluzio eta gai elkartuen artean. Izan ere, alde horiek zehaztasunez finkatu zirenerako, ondo sartuta zegoen XIX. mendea. Bere “Query 31” galderan, honela zioen Newtonek:
“Ez al dituzte gorputzen zatiki txikek halako ahalmen, bertute edo ahalmenak, urrutira eragiten dutenak, ez bakarrik argi izpien gainean, izpi horiek islatuz, errefraktatuz eta desbideratuz, aldiz, baita elkarren gainean ere, izadiko fenomenoen parte handi bat sorrarazteko? Izan ere, gauza jakina da grabitate, magnetismo eta elektrizitatearen erakarpenaren bidez eragiten dietela gorputzek batak besteari; eta kasu horiek izadiaren nolakotasuna eta ibilbidea erakusten dute, eta erakarpen indar gehiago izan daitekeela ere ikusarazten digute. Zeren izadia oso egonkorra baita, eta beti berdina izateko joera baitu. Ez dut hemen aztertuko nola gerta daitezkeen erakarpen horiek. Nik erakarpen deitzen dudan hori bultzadaz gerta liteke, edo nik ezagutzen ez dudan beste moduren batez…”
Izan ere, zientzia kimikoaren arazo handietako bat da kimika gaien arteko afinitatearen sorburua. Orain dakigunaren arabera, grabitate erakarpenak ez du zerikusirik afinitate kimikoarekin, eta ez dira beharrezkoak Newtonek aipatzen dituen indar klase berri horiek. Aurrerago ikusiko dugu nola Newtonek 1714an argitaraturiko galderari 1926an erantzun zitzaion, quantumen teoria kimikako arazoei aplikatu zitzaienean; kimika erakarpena, berez, fenomeno elektrikoa dela izango litzateke funtsean erantzuna.
Alabaina, ohiko gauza denez, kimika afinitateen mekanismo mikroskopiko xeheaz gainera, fenomenoen beren analisi matematikoa bideratzen dute termodinamikaren metodo ahaltsuek, eta zehaztasunez deskribatzen dute nolako eragina duten afinitate kimikoan, beste faktoreen artean, tenperaturak, presioak eta kontzentrazioak.
Kimika erreaktibotasunei buruzko datu esperimentalak lehen Afinitate Taula direlakoetan laburbildu ziren; hala, azidoek zein ordenatan kanporatzen dituzten azido ahulak baseekiko konbinazioetatik adierazten zuen Etienne Geoffroyrenak (1718).
Claude Louis Bertholletek, 1801ean, Essai de statique chimique liburuan ("Kimika estatikoaren gainean"), taula horiek berez okerrak zirela zioen;
izan ere, haren arabera, erreaktibo kopuruak paper garrantzitsua jokatzen du errakzioan, eta atzera itzul daiteke erreakzioa erreaktibo batetik
gehiegi ipintzen baldin bada. Napoleonen zientzia aholkulari gisa zebilela 1799ko Egiptoko espedizioan, ikusi zuen sodio karbonatoa jalkitzen
zela aintzira gazien bazterretan. 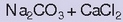
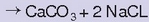 erreakzioa, laboratorioan egiten zen eran,
erreakzioa, laboratorioan egiten zen eran,
 hauspeatzen zenean amaitzen zen. Berthollet konturatu zen ezen,
lurrintzen ziren gatzunetan zegoen gehiegizko sodio kloruroaren
eraginez, erreakzioa atzera itzul zitekeela, eta kararria sodio karbonato
bihurtu. Alabaina, urrutiegi joan zen; hala, haren aburuz, gai elkartu
kimikoen konposizio erreala aldatu egin zitekeen erreakzioko
nahasketaren proportzioak aldatuz gero. Geroago Louis Proustekin
izan zuen eztabaidan, ondo finkatua geratu zen proportzio definituen
legea; alabaina, oreka kimikoei buruzko Bertholleten ideiek ospea
galdu zuten, beren alde on eta alde txarrekin, eta, hortaz, ideia haiek
baztertuak geratu ziren berrogeita hamar bat urtez. Gaur egun ondo
ezagutzen dira konposizio estekiometrikoari buruzko desbiderapenen
adibide argi asko, gai elkartu inorganiko gotor zenbaitetan, hala oxido
eta sulfuro metalikoetan; izan ere, horrexegatik deitzen dira
bertolido, horiek eta daltonidoak bereizteko, azken horietan
zehaztasunez gordetzen baitira proportzio definituak.
hauspeatzen zenean amaitzen zen. Berthollet konturatu zen ezen,
lurrintzen ziren gatzunetan zegoen gehiegizko sodio kloruroaren
eraginez, erreakzioa atzera itzul zitekeela, eta kararria sodio karbonato
bihurtu. Alabaina, urrutiegi joan zen; hala, haren aburuz, gai elkartu
kimikoen konposizio erreala aldatu egin zitekeen erreakzioko
nahasketaren proportzioak aldatuz gero. Geroago Louis Proustekin
izan zuen eztabaidan, ondo finkatua geratu zen proportzio definituen
legea; alabaina, oreka kimikoei buruzko Bertholleten ideiek ospea
galdu zuten, beren alde on eta alde txarrekin, eta, hortaz, ideia haiek
baztertuak geratu ziren berrogeita hamar bat urtez. Gaur egun ondo
ezagutzen dira konposizio estekiometrikoari buruzko desbiderapenen
adibide argi asko, gai elkartu inorganiko gotor zenbaitetan, hala oxido
eta sulfuro metalikoetan; izan ere, horrexegatik deitzen dira
bertolido, horiek eta daltonidoak bereizteko, azken horietan
zehaztasunez gordetzen baitira proportzio definituak.
1 Walter J. Mooreren Kimika fisikoa obratik hartua.
Urmo, SA de Ediciones, Bilbo, 1977.



